|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
O2 + 2SO2 = 2SO3 | Cân Bằng Phương Trình Hóa Học
O2 | oxi | khí + SO2 | lưu hùynh dioxit | khí = SO3 | sulfuarơ | lỏng, Điều kiện Nhiệt độ 450, Chất xúc tác V2O5
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình O2 + 2SO2 → 2SO3
- Điều kiện phản ứng để O2 (oxi) tác dụng SO2 (lưu hùynh dioxit) là gì ?
- Làm cách nào để O2 (oxi) tác dụng SO2 (lưu hùynh dioxit)?
- Hiện tượng nhận biết nếu phản ứng xảy ra O2 + 2SO2 → 2SO3 là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng O2 + 2SO2 → 2SO3 ?
- Giải thích chi tiết về các phân loại của phương trình O2 + 2SO2 → 2SO3
- Chuỗi phương trình hóa học có sử dụng O2 + 2SO2 → 2SO3
Cách viết phương trình đã cân bằng
 |  | .jpg) | |||
| O2 | + | 2SO2 | ↔ | 2SO3 | |
| oxi | lưu hùynh dioxit | sulfuarơ | |||
| Sulfur đioxit | Sulfur trioxit | ||||
| (khí) | (khí) | (lỏng) | |||
| (không màu) | (không màu) | (không màu) | |||
| 32 | 64 | 80 | |||
| 1 | 2 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình O2 + 2SO2 → 2SO3
O2 + 2SO2 → 2SO3 là Phản ứng oxi-hoá khử, O2 (oxi) phản ứng với SO2 (lưu hùynh dioxit) để tạo ra SO3 (sulfuarơ) dười điều kiện phản ứng là Nhiệt độ: 450°C Xúc tác: V2O5
Điều kiện phản ứng O2 (oxi) tác dụng SO2 (lưu hùynh dioxit) là gì ?
Nhiệt độ: 450°C Xúc tác: V2O5
Làm cách nào để O2 (oxi) tác dụng SO2 (lưu hùynh dioxit) xảy ra phản ứng?
so2 bị oxi hóa bởi oxi
Nếu đang làm bài tập các bạn có thể viết đơn giản là O2 (oxi) tác dụng SO2 (lưu hùynh dioxit) và tạo ra chất SO3 (sulfuarơ)
Hiện tượng nhận biết nếu phản ứng xảy ra O2 + 2SO2 → 2SO3 là gì ?
giải phóng khí SO3.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng O2 + 2SO2 → 2SO3
Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này. Bạn có thể kéo xuống dưới bạn click vào nút báo lỗi / đóng góp để đưa thêm thông tin
Phương Trình Điều Chế Từ O2 Ra SO3
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ O2 (oxi) ra SO3 (sulfuarơ)
Xem tất cả phương trình điều chế từ O2 (oxi) ra SO3 (sulfuarơ)Phương Trình Điều Chế Từ SO2 Ra SO3
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ SO2 (lưu hùynh dioxit) ra SO3 (sulfuarơ)
Xem tất cả phương trình điều chế từ SO2 (lưu hùynh dioxit) ra SO3 (sulfuarơ)Giải thích chi tiết về các phân loại của phương trình O2 + 2SO2 → 2SO3
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Phản ứng thuận nghịch (cân bằng) là gì ?
Khi nó xảy ra theo hai chiều ngược nhau trong cùng một điều kiện. Do đó, phản ứng cân bằng xảy ra không hoàn toàn, nghĩa là sau phản ứng không những thu được sản phẩm (C, D) mà còn có cả các tác chất (A, B).
Xem tất cả phương trình Phản ứng thuận nghịch (cân bằng)
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình O2 + 2SO2 → 2SO3
Click để xem tất cả câu hỏi có liên quan tới phương trình O2 + 2SO2 → 2SO3Câu 1. Cân bằng hóa học
Cho các cân bằng:
1) H2 + I2(rắn) ←→ 2HI
2) N2 + 3H2 ←→ 2NH3
3) H2 + Cl2 ←→ 2HCl
4) 2SO2 (k) + O2 (k) ←→ 2SO3
5) SO2 + Cl2 ←→ SO2Cl2
Khi tăng áp suất chung của cả hệ số cân bằng chuyển dịch theo chiều thuận và
chiều nghịch lần lượt là:
A. 3 và 2
B. 3 và 1
C. 2 và 4
D. 2 và 5
Xem đáp án câu 1
Câu 2. Chọn phát biểu sai
Phát biểu không đúng là
A. CO2 là thủ phạm chính của hiện tượng biến đổi khí hậu
B. CF2Cl2 là thủ phạm chính gây thủng tầng ozon.
C. SO2 là thủ phạm chính của hiện tượng mưa axit.
D. Nhiên liệu hóa thạch các nước đang sử dụng như than đá, dầu mỏ, khí tự nhiên… là nhiên liệu sạch.
Xem đáp án câu 2
Câu 3. Hợp chất lưu huỳnh
Cho các nhận định sau:
(1). Khi sục SO2 vào dung dịch H2S thì dung dịch chuyển thành màu nâu đen.
(2). SO2 luôn thể hiện tính khử trong các phản ứng với O2, nước Br2, dung dịch
KMnO4.
(3). Trong các phản ứng sau:
1) SO2 + Br2 + H2O
2) SO2 + O2 (to, xt)
3) SO2 + KMnO4 + H2O
4) SO2 + NaOH
5) SO2 + H2S
6) SO2 + Mg.
Có 4 phản ứng mà SO2 thể hiện tính oxi hóa.
(4). Hiện tượng xảy ra khi dẫn khí H2S vào dung dịch hỗn hợp KMnO4 và
H2SO4 là dung dịch bị mất màu tím.
(5). Các chất O3, KClO4, H2SO4, Fe(NO3)3 chỉ có tính oxi hóa.
(6). Bạc tiếp xúc với không khí có lẫn H2S bị hóa đen.
(7). Tác nhân chủ yếu gây mưa axit là SO2, NO2.
(8). Sục khí H2S vào dung dịch FeCl2 không xảy ra phản ứng.
Số nhận định đúng là:
A. 4
B. 3
C. 5
D. 6
Xem đáp án câu 3
Câu 4. Chất phản ứng với oxi ở điều kiện thường
Cho các chất: N2, H2S, SO2, HBr, CO2. Có bao nhiêu chất có phản ứng với
O2 ở điều kiện thích hợp?
A. 4
B. 3
C. 5
D. 2
Xem đáp án câu 4
Câu 5. Chất tác dụng với oxi ở điều kiện thường
Cho các chất: N2, H2S, SO2, HBr, CO2. Có bao nhiêu chất có phản ứng với
O2 ở điều kiện thích hợp?
A. 4
B. 3
C. 5
D. 2
Xem đáp án câu 5
Câu 6. Phản ứng tạo ra sản phẩm mà lưu huỳnh ở mức số oxi hóa +6
Cho các chất tham gia phản ứng:
(1). S+ F2 →
(2). SO2 + H2S →
(3). SO2 + O2 →
(4). S+H2SO4(đặc, nóng) →
(5). H2S + Cl2 (dư ) + H2O →
(6). FeS2 + HNO3 →
Khi các điều kiện xúc tác và nhiệt độ có đủ, số phản ứng tạo ra sản phẩm mà
lưu huỳnh ở mức số oxi hóa +6 là:
A. 4
B. 5
C. 2
D. 3
Xem đáp án câu 6
Câu 7. Câu hỏi lý thuyết về tác nhân gây mưa acid
Tác nhân chủ yếu gây mưa axit là
A. SO2 và NO2
B. CH4 và NH3
C. CO và CH4
D. CO và CO2.
Xem đáp án câu 7
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Chuỗi phương trình hóa học có sử dụng O2 + 2SO2 → 2SO3
Chuỗi phản ứng về hidro sunfua lưu huỳnh

Oxi hóa pyrit sắt trong không khí, sau một thời gian tạo thành sản phẩm có màu đỏ là oxit sắt (III) oxit và có khí SO2 thoát ra.
SO2 phản ứng với oxi tạo thành sản phẩm SO3 có chất xúc tác V2O3, ở nhiệt độ 450 độ C.
Tiếp tục cho SO3 hòa tan trong nước, sản phẩm tạo thành là axit sunfuric H2SO4.
Sau đó cho kim loại đồng phản ứng với axit sunfuric đặc, nóng, sản phẩm tạo thành có khí SO2 thoát ra và muối đồng (II) sunfat.
Cho CuSO4 hòa tan trong dung dịch kiềm NaOH, phản ứng tạo thành có kết tủa xanh lơ là Cu(OH)2.
Lấy sản phẩm Cu(OH)2 đem đi nhiệt phân ta thu được CuO có màu đen.
Tiếp tục nhiệt phân CuO ở nhiệt độ 100 độ C thu được sản phẩm có màu đỏ gạch là Cu2O.
Cho Cu2O qua luồng khí CO sản phẩm tạo thành có khí CO2 thoát ra và Cu kết tủa màu đỏ bám trên thành ống nghiệm.
Tiếp tục cho kim loại Cu tác dụng với AgSO4 sản phẩm tạo thành có hiện tượng kết tủa trắng là Ag, muối CuSO4.
Nhiệt phân muối CuSO4 ở nhiệt độ cao thu được oxit kim loại màu đen là CuO, khí có mùi hắc là SO2.
Dẫn khí SO2 qua dung dịch nước brom sản phẩm tạo thành gồm 2 axit sunfuric và HBr.
Sau đó, điện phân dung dịch HBr ta thu được 2 khí gồm bromua và hidro.
Sục khí SO2 trong dung dịch brom thu được axit sunfuric.
Phương trình liên quan
Có 13 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về oxi lưu huỳnh

Đốt cháy lưu huỳnh trong không khí sản phẩm thu được là khí không màu, mùi hắc SO2.
Đốt cháy SO2 trong không khí có chất xúc tác V2O5, nhiệt độ 450 độ C sản phẩm tạo thành là SO3.
Tiếp tục hòa tan khí SỎ trong nước ta sẽ thu được dung dịch axit sunfuric.
Tiếp theo, cho kim loại sắt phản ứng với axit sunfuric đậm đặc, sản phẩm tạo thành có Fe2(SO4)3, khí SO2 không màu thoát ra.
Đốt cháy lưu huỳnh với khí hidro ta thu được khí có mùi trứng thối là H2S.
Tiếp theo đốt cháy lưu huỳnh trong không khí tạo thành khí SO2.
Cho kim loại sắt phản ứng với lưu hình sản phẩm tạo thành chất rắn màu đen là FeS.
Dẫn khí SO2 vào dung dịch Axit Sunfuhiđric H2S, xuất hiện kết tủa vàng Lưu huỳnh (S).
Sục khí SO2 trong dung dịch nước brom thu được axit sunfuric.
Tiếp theo cho FeS tác dụng với HBr thu được sản phẩm có mùi trứng thối thoát ra đó là H2S
Phương trình liên quan
Có 9 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về oxi lưu huỳnh
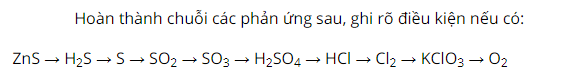
Cho ZnS tác dụng với axit clohidric, sản phẩm tạo thành có khí mùi trứng thối thoát ra là H2S.
Tiếp tục cho khí H2S đốt cháy trong điều kiện thiếu oxi sản phẩm thu được là lưu huỳnh.
Đốt cháy lưu huỳnh trong không khí thu được sản phẩm là khí SO2 không màu, mùi hắc.
Đem khí SO2 đốt cháy trong không khí có chất xúc tác V2O5, nhiệt độ 450 độ C sản phẩm tạo thành là SO3.
Hòa tan SO3 trong nước ta thu được axit sunfuric.
Tiếp theo, cho tinh thể NaCl tác dụng với axit H2SO4 đặc sản phẩm ta thu được axit HCl.
Sau đó cho axit HCl phản ứng với MnO2 sản phẩm có khí clo thoát ra.
Sục khí clo trong dung dịch KOH ở nhiệt độ 100 độ C ta thu được muối kali clorat.
Nhiệt phân muối kali clorat ở nhiệt độ cao, chất xúc tác MnO2 có khí oxi thoát ra và thu được muối KCl.
Phương trình liên quan
Có 8 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về oxi lưu huỳnh
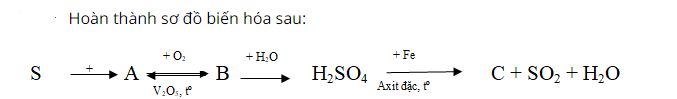
Đốt cháy lưu huỳnh trong không khí thu được lưu huỳnh đioxit mùi hắc, không màu (chất A).
Tiếp tục đem SO2 đốt cháy trong không khí ở nhiệt độ cao sản phẩm tạo thành là SO3.
Sau đó, hòa tan SO3 trong nước sản phẩm thu được dung dịch axit H2SO4.
Cuối cùng, cho kim loại sắt hòa tan trong dung dịch axit sunfuric đặc, sản phẩm tạo thành có khí không màu thoát ra và muối Fe2(SO4)3.
Phương trình liên quan
Có 3 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về oxi lưu huỳnh
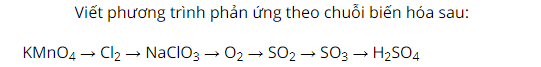
Cho KMnO4 hòa tan trong dung dịch axit HCl sau phản ứng có khí màu vàng thoát ra là clo.
Sau đó, sục khí clo qua dung dịch kiềm NaOH sản phẩm tạo thành có muối natri clorat NaClO3.
Nhiệt phân muối natri clorat sản phẩm có khí không màu thoát ra là oxi.
Tiếp tục cho oxi phản ứng với lưu huỳnh, sản phẩm thu được là khí SO2.
Sau đó, cho khí SO2 phản ứng với oxi sản phẩm tạo thành là chất lỏng, không màu.
Tiếp tục hòa tan SO3 trong nước ta thu được dung dịch axit H2SO4.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về phi kim
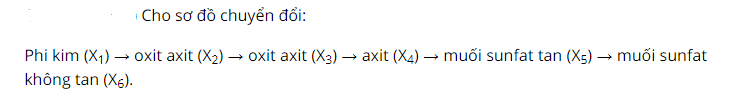
Đốt cháy lưu huỳnh trong không khí, sản phẩm tạo thành là khí không màu thoát ra SO2.
Tiếp tục đem khí lưu huỳnh đioxit đốt trong không khí, sản phẩm tạo thành là chất lỏng không màu SO3.
Sau đó, hòa tan SO3 trong môi trường nước, ta thu được axit sunfuric.
Cho axit sunfuric phản ứng với dung dịch natri hidroxit sản phẩm tạo thành là muối natri sunfat.
Cuối cùng cho muối natri sunfat phản ứng với bari clorua sau phản ứng có hiện tượng kết tủa trắng là BaSO4
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng vô cơ
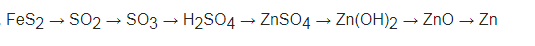
1) Đầu tiên cho FeS2 cháy trong O2 tạo thành Fe2O3 và có khí thoát ra SO2
2) Sau đó, cho SO2 cháy trong O2 kết quả thu được khí SO3
3) Kế tiếp, cho SO3 phản ứng với H2O thu được H2SO4
4) Tiếp theo, cho H2SO4 phản ứng với Zn tạo thành ZnSO4 và có khí bay ra.
5) Sau đó, cho ZnSO4 tác dụng với NaOH tạo thành Zn(OH)2 và Na2SO4
6) Nhiệt phân Zn(OH)2 sản phẩm thu được ZnO và H2O
7) Cuối cùng, cho ZnO tác dụng H2 tạo thành Zn vào nước.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về phi kim và hợp chất của phi kim
Đốt cháy lưu huỳnh trong không khí sản phẩm tạo thành là khí SO2.
Tiếp tục đem SO2 đốt cháy trong không khí sản phẩm thu được là SO3.
Sau đó, dẫn SO3 qua nước sau phản ứng tạo thành axit sunfuric.
Cho axit sunfuric tác dụng với dung dịch bazo NaOH sản phẩm sau phản ứng là muối natri sunfat.
Cuối cùng cho muối natri sunfat bar clorua sản phẩm có hiee65n tượng kết tủa trắng là BaSO4.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phương trình phản ứng về kim loại, phi kim và axit

Cho pyrit sắt phản ứng với oxi sản phẩm tạo thành có hiện tượng khí thoát ra là khí SO2.
Đốt cháy khí SO2 trong không khí, sản phẩm tạo thành là chất lỏng SO3.
Cho chất lỏng SO3 tác dụng với nước tạo thành axit sunfuric.
Cuối cùng cho axit sunfuric tác dụng với natri axetat sản phẩm tạo thành là axit axetic.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Bài Viết Hóa Học Liên Quan
Bài 33. Axit sunfuric – Muối sunfat
Nội dung bài học Axit sunfuric - Muối sunfat tìm hiểu axit sunfuric đặc và loãng có những tính chất hóa học nào giống và khác những axit khác? Axit sunfuric có vai trò như thế nào đến nền kinh tế quốc dân? Phương pháp sản xuất axit sunfuric như thế nào?
Bài 45. Hợp chất có oxi của lưu huỳnh
Lưu huỳnh dioxxit, lưu huỳnh trioxit có cấu tạo phân tử và tính chất hóa học nào? Những phản ứng hóa học nào có thể chứng minh điều này?
Bài 50. Cân bằng hóa học
Hiểu cân bằng hóa học và đại lượng đặc trưng cho nó là hằng số cân bằng. hiểu sự chuyển dịch cân bằng là gì và chuyển dịch như thế nào khi biến đổi nồng độ. áp suất, nhiệt độ.
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Bài học liên quan
Các bài học trong sách giáo khoa có sử dụng phương trình hóa học này:
Bài 33. Axit sunfuric – Muối sunfat" Bài 45. Hợp chất có oxi của lưu huỳnh" Bài 50. Cân bằng hóa học"Phương trình sản xuất ra O2 (oxi)
(oxygen)
2H2O → 2H2 + O2 2KNO3 → 2KNO2 + O2 2Cu(NO3)2 → 2CuO + 4NO2 + O2 Tổng hợp tất cả phương trình điều chế ra O2Phương trình sản xuất ra SO2 (lưu hùynh dioxit)
(sulfur dioxide)
H2SO4 + Na2SO3 → H2O + Na2SO4 + SO2 2H2S + 3O2 → 2H2O + 2SO2 Cu + 2H2SO4 → 2H2O + SO2 + CuSO4 Tổng hợp tất cả phương trình điều chế ra SO2Phương trình sử dụng SO3 (sulfuarơ) là chất sản phẩm
()
2SO3 → O2 + 2SO2 2NH3 + 3SO3 → H2O + N2 + 3SO2 BaO + SO3 → BaSO4 Tổng hợp tất cả phương trình có SO3 tham gia phản ứng















