|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 | Cân Bằng Phương Trình Hóa Học
FeS2 | Pyrit sắt | + O2 | oxi | khí = Fe2O3 | sắt (III) oxit | + SO2 | lưu hùynh dioxit | khí, Điều kiện Nhiệt độ nhiệt độ
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- Điều kiện phản ứng để FeS2 (Pyrit sắt) tác dụng O2 (oxi) là gì ?
- Làm cách nào để FeS2 (Pyrit sắt) tác dụng O2 (oxi)?
- Hiện tượng nhận biết nếu phản ứng xảy ra 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 ?
- Giải thích chi tiết về các phân loại của phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- Chuỗi phương trình hóa học có sử dụng 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Cách viết phương trình đã cân bằng
 |  | .jpg) |  | ||||
| 4FeS2 | + | 11O2 | → | 2Fe2O3 | + | 8SO2 | |
| Pyrit sắt | oxi | sắt (III) oxit | lưu hùynh dioxit | ||||
| Iron(III) oxide | Sulfur đioxit | ||||||
| (khí) | (khí) | ||||||
| (vàng đồng nhạt) | (không màu) | (nâu đỏ) | (không màu) | ||||
| 120 | 32 | 160 | 64 | ||||
| 4 | 11 | 2 | 8 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 là Phản ứng oxi-hoá khử, FeS2 (Pyrit sắt) phản ứng với O2 (oxi) để tạo ra Fe2O3 (sắt (III) oxit), SO2 (lưu hùynh dioxit) dười điều kiện phản ứng là Nhiệt độ: nhiệt độ
Điều kiện phản ứng FeS2 (Pyrit sắt) tác dụng O2 (oxi) là gì ?
Nhiệt độ: nhiệt độ
Làm cách nào để FeS2 (Pyrit sắt) tác dụng O2 (oxi) xảy ra phản ứng?
Chúng mình không thông tin về làm thế nào để FeS2 (Pyrit sắt) phản ứng với O2 (oxi) và tạo ra chất Fe2O3 (sắt (III) oxit) phản ứng với SO2 (lưu hùynh dioxit).
Bạn có thể kéo xuống dưới và click vào nút báo lỗi để đóng góp thông tin cho chúng mình nhé.Nếu đang làm bài tập các bạn có thể viết đơn giản là FeS2 (Pyrit sắt) tác dụng O2 (oxi) và tạo ra chất Fe2O3 (sắt (III) oxit), SO2 (lưu hùynh dioxit)
Hiện tượng nhận biết nếu phản ứng xảy ra 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 là gì ?
Fe2O3 màu nâu đỏ
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Trong công nghiệp, SO2 được sản xuất bằng cách đốt S hoặc quặng pirit sắt.
Phương Trình Điều Chế Từ FeS2 Ra Fe2O3
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ FeS2 (Pyrit sắt) ra Fe2O3 (sắt (III) oxit)
Xem tất cả phương trình điều chế từ FeS2 (Pyrit sắt) ra Fe2O3 (sắt (III) oxit)Phương Trình Điều Chế Từ FeS2 Ra SO2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ FeS2 (Pyrit sắt) ra SO2 (lưu hùynh dioxit)
Xem tất cả phương trình điều chế từ FeS2 (Pyrit sắt) ra SO2 (lưu hùynh dioxit)Phương Trình Điều Chế Từ O2 Ra Fe2O3
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ O2 (oxi) ra Fe2O3 (sắt (III) oxit)
Xem tất cả phương trình điều chế từ O2 (oxi) ra Fe2O3 (sắt (III) oxit)Phương Trình Điều Chế Từ O2 Ra SO2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ O2 (oxi) ra SO2 (lưu hùynh dioxit)
Xem tất cả phương trình điều chế từ O2 (oxi) ra SO2 (lưu hùynh dioxit)Giải thích chi tiết về các phân loại của phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Click để xem tất cả câu hỏi có liên quan tới phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2Câu 1. Thí nghiệm
Một chén sứ có khối lượng m1 gam. Cho vào chén một hợp chất X, cân lại thấy có khối lượng m2 gam. Nung chén đó trong không khí đến khối lượng không đổi, rồi để nguội chén, cân lại thấy nặng m3 gam, biết m1 < m3 < m2. Có bao nhiêu chất trong các chất cho sau đây thỏa mãn thí nghiệm trên: NaHCO3, NaNO3, NH4Cl, I2, K2CO3, Fe, Fe(OH)2 và FeS2 ?
A. 5
B. 6
C. 4
D. 3
Xem đáp án câu 1
Câu 2. Điều chế
Phản ứng không dùng để điều chế khí phù hợp trong phòng thí nghiệm là:
A. KMnO4 (t0)→
B. NaCl + H2SO4 đặc (t0)→
C. NH4Cl + Ca(OH)2 (t0)→
D. FeS2 + O2 →
Xem đáp án câu 2
Câu 3. Phản ứng tạo khí SO2
Trong các hóa chất Cu, C, S, Na2SO3, FeS2, FeSO4; O2, H2SO4 đặc. Cho
từng cặp chất phản ứng với nhau thì số cặp chất có phản ứng tạo ra khí SO2 là:
A. 6
B. 7
C. 9
D. 8
Xem đáp án câu 3
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Chuỗi phương trình hóa học có sử dụng 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Chuỗi phản ứng về sắt crom
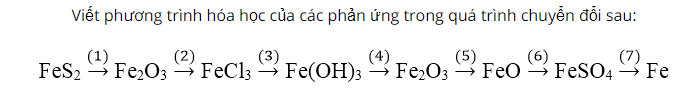
Oxi hóa pyrit sắt trong không khí, sau một thời gian thu được oxit sắt (III) màu đỏ Fe2O3.
Sau đó cho oxit sắt III phản ứng với axit HCl sản phẩm tạo thành muối sắt III clorua màu nâu đen. Tiếp tục cho FeCl3 phản ứng với dung dịch bazo NaOh sản phẩm kết tủa màu nâu đỏ.
Sau đó, nhiệt phân Fe(OH)3 thu được oxit sắt (III) màu đỏ.
Dẫn luồng khí H2 qua Fe2O3 thu được sản phẩm sắt (II) oxit. Sau đó, cho FeO tác dụng với axit H2SO4 loãng thu được sản phẩm muối sắt (II) sunfat.
Cuối cùng cho muối FeSO4 tác dụng với kim loại magie thu được MgSO4 và Fe.
Phương trình liên quan
Có 7 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về hidro sunfua lưu huỳnh

Oxi hóa pyrit sắt trong không khí, sau một thời gian tạo thành sản phẩm có màu đỏ là oxit sắt (III) oxit và có khí SO2 thoát ra.
SO2 phản ứng với oxi tạo thành sản phẩm SO3 có chất xúc tác V2O3, ở nhiệt độ 450 độ C.
Tiếp tục cho SO3 hòa tan trong nước, sản phẩm tạo thành là axit sunfuric H2SO4.
Sau đó cho kim loại đồng phản ứng với axit sunfuric đặc, nóng, sản phẩm tạo thành có khí SO2 thoát ra và muối đồng (II) sunfat.
Cho CuSO4 hòa tan trong dung dịch kiềm NaOH, phản ứng tạo thành có kết tủa xanh lơ là Cu(OH)2.
Lấy sản phẩm Cu(OH)2 đem đi nhiệt phân ta thu được CuO có màu đen.
Tiếp tục nhiệt phân CuO ở nhiệt độ 100 độ C thu được sản phẩm có màu đỏ gạch là Cu2O.
Cho Cu2O qua luồng khí CO sản phẩm tạo thành có khí CO2 thoát ra và Cu kết tủa màu đỏ bám trên thành ống nghiệm.
Tiếp tục cho kim loại Cu tác dụng với AgSO4 sản phẩm tạo thành có hiện tượng kết tủa trắng là Ag, muối CuSO4.
Nhiệt phân muối CuSO4 ở nhiệt độ cao thu được oxit kim loại màu đen là CuO, khí có mùi hắc là SO2.
Dẫn khí SO2 qua dung dịch nước brom sản phẩm tạo thành gồm 2 axit sunfuric và HBr.
Sau đó, điện phân dung dịch HBr ta thu được 2 khí gồm bromua và hidro.
Sục khí SO2 trong dung dịch brom thu được axit sunfuric.
Phương trình liên quan
Có 13 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng phản ứng hóa học

a) Đầu tiên cho FexOy phản ứng với hidro sản phẩm thu được là sắt
b) Đốt cháy benzen trong không khí, sản phẩm thu được là khí CO2 và hơi nước.
c) Cho FeS2 tác dụng với O2 sản phẩm tạo thành là Fe2O3 và khí lưu huỳnh đioxit.
d) Đốt cháy CxHy sản phẩm tạo thành CO2 và hơi nước
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng vô cơ
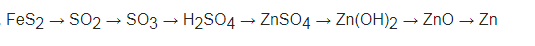
1) Đầu tiên cho FeS2 cháy trong O2 tạo thành Fe2O3 và có khí thoát ra SO2
2) Sau đó, cho SO2 cháy trong O2 kết quả thu được khí SO3
3) Kế tiếp, cho SO3 phản ứng với H2O thu được H2SO4
4) Tiếp theo, cho H2SO4 phản ứng với Zn tạo thành ZnSO4 và có khí bay ra.
5) Sau đó, cho ZnSO4 tác dụng với NaOH tạo thành Zn(OH)2 và Na2SO4
6) Nhiệt phân Zn(OH)2 sản phẩm thu được ZnO và H2O
7) Cuối cùng, cho ZnO tác dụng H2 tạo thành Zn vào nước.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về kim loại sắt và hợp chất sắt

Đốt cháy pyrit sắt trong không khí sau một thời gian sản phẩm tạo thành có màu nâu đỏ là Fe2O3.
Thổi luồng khí CO qua kim loại sắt (III) oxit sản phẩm tạo thành là sắt từ và có khí không màu thoát ra.
Tiếp tục thổi luồng khí CO qua sắt từ, sản phẩm tạo thành có hiện tượng kết tủa đen là FeO.
Sau đó, đem oxit sắt FeO thổi qua luồng khí CO, sản phẩm thu được là kim loại sắt.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phương trình phản ứng về kim loại, phi kim và axit

Cho pyrit sắt phản ứng với oxi sản phẩm tạo thành có hiện tượng khí thoát ra là khí SO2.
Đốt cháy khí SO2 trong không khí, sản phẩm tạo thành là chất lỏng SO3.
Cho chất lỏng SO3 tác dụng với nước tạo thành axit sunfuric.
Cuối cùng cho axit sunfuric tác dụng với natri axetat sản phẩm tạo thành là axit axetic.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Bài Viết Hóa Học Liên Quan
Bài 32. Hiđro sunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit
Nội dung bài học Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit tìm hiểu Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit có những tính chất nào giống và khác nhau? Vì sao? Những phản ứng hóa học có thể chứng minh cho những tính chất này
Bài 33. Axit sunfuric – Muối sunfat
Nội dung bài học Axit sunfuric - Muối sunfat tìm hiểu axit sunfuric đặc và loãng có những tính chất hóa học nào giống và khác những axit khác? Axit sunfuric có vai trò như thế nào đến nền kinh tế quốc dân? Phương pháp sản xuất axit sunfuric như thế nào?
Bài 45. Hợp chất có oxi của lưu huỳnh
Lưu huỳnh dioxxit, lưu huỳnh trioxit có cấu tạo phân tử và tính chất hóa học nào? Những phản ứng hóa học nào có thể chứng minh điều này?
Bài 2. Một số oxit quan trọng
Canxi 0xit có những tính chất, ứng dụng gì và được sản xuất như thế nào ? Lưu huỳnh đioxit có những tính chất, ứng dụng gì ? Điều chẽ nó như thế nào ?
Bài 4. Một số axit quan trọng
Axit clohidric có những tính chất của axit không ? Nó có những ứng dụng quan trọng nào ? Axit sunfuric đặc và loãng có những tính chất hoá học nào ? Vai trò quan trọng của nó là gì ?
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Bài học liên quan
Các bài học trong sách giáo khoa có sử dụng phương trình hóa học này:
Bài 32. Hiđro sunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit" Bài 33. Axit sunfuric – Muối sunfat" Bài 45. Hợp chất có oxi của lưu huỳnh" Bài 2. Một số oxit quan trọng" Bài 4. Một số axit quan trọng"Phương trình sản xuất ra FeS2 (Pyrit sắt)
(Pyrite; Marcasite)
2H2S + 2FeCl3 → FeCl2 + FeS2 + 4HCl Tổng hợp tất cả phương trình điều chế ra FeS2Phương trình sản xuất ra O2 (oxi)
(oxygen)
2KNO3 → 2KNO2 + O2 2H2O → 2H2 + O2 2Cu(NO3)2 → 2CuO + 4NO2 + O2 Tổng hợp tất cả phương trình điều chế ra O2Phương trình sử dụng Fe2O3 (sắt (III) oxit) là chất sản phẩm
(iron oxide)
2Al + Fe2O3 → Al2O3 + 2Fe 4Cl2 + 2Fe2O3 → 4FeCl2 + 3O2 6Fe2O3 → O2 + 4Fe3O4 Tổng hợp tất cả phương trình có Fe2O3 tham gia phản ứngPhương trình sử dụng SO2 (lưu hùynh dioxit) là chất sản phẩm
(sulfur dioxide)
2H2O + 2KMnO4 + 5SO2 → 2H2SO4 + 2MnSO4 + K2SO4 2SO2 + Ba(OH)2 → Ba(HSO3)2 H2O + SO2 → H2SO3 Tổng hợp tất cả phương trình có SO2 tham gia phản ứng















