Chuỗi phản ứng vô cơ
Chuỗi phương trình hóa học về hỗn hợp sắt, lưu huỳnh và kẽm
Chuỗi phản ứng vô cơ
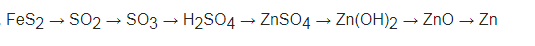
1) Đầu tiên cho FeS2 cháy trong O2 tạo thành Fe2O3 và có khí thoát ra SO2
2) Sau đó, cho SO2 cháy trong O2 kết quả thu được khí SO3
3) Kế tiếp, cho SO3 phản ứng với H2O thu được H2SO4
4) Tiếp theo, cho H2SO4 phản ứng với Zn tạo thành ZnSO4 và có khí bay ra.
5) Sau đó, cho ZnSO4 tác dụng với NaOH tạo thành Zn(OH)2 và Na2SO4
6) Nhiệt phân Zn(OH)2 sản phẩm thu được ZnO và H2O
7) Cuối cùng, cho ZnO tác dụng H2 tạo thành Zn vào nước.
Tóm Tắt Phương Trình Liên Quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Đánh giá
Chi Tiết Phương Trình Liên Quan
Xin lưu ý đây chỉ là phương trình chúng tôi đề nghị, bạn hoàn toàn có thể dùng các phương trình thay thể thỏa điều kiệm của chuỗi
Chi Tiết Phương Trình Số 1
Phương Trình Kết Quả Số #2
Cách viết phương trình đã cân bằng
 |  | .jpg) |  | ||||
| 4FeS2 | + | 11O2 | → | 2Fe2O3 | + | 8SO2 | |
| Pyrit sắt | oxi | sắt (III) oxit | lưu hùynh dioxit | ||||
| Iron(III) oxide | Sulfur đioxit | ||||||
| (khí) | (khí) | ||||||
| (vàng đồng nhạt) | (không màu) | (nâu đỏ) | (không màu) | ||||
| 4 | 11 | 2 | 8 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 là Phản ứng oxi-hoá khử, FeS2 (Pyrit sắt) phản ứng với O2 (oxi) để tạo ra Fe2O3 (sắt (III) oxit), SO2 (lưu hùynh dioxit) dười điều kiện phản ứng là Nhiệt độ: nhiệt độ
Điều kiện phản ứng FeS2 (Pyrit sắt) tác dụng O2 (oxi) là gì ?
Nhiệt độ: nhiệt độ
Làm cách nào để FeS2 (Pyrit sắt) tác dụng O2 (oxi) xảy ra phản ứng?
Chúng mình không thông tin về làm thế nào để FeS2 (Pyrit sắt) phản ứng với O2 (oxi) và tạo ra chất Fe2O3 (sắt (III) oxit) phản ứng với SO2 (lưu hùynh dioxit).
Bạn có thể kéo xuống dưới và click vào nút báo lỗi để đóng góp thông tin cho chúng mình nhé.Hiện tượng nhận biết nếu phản ứng xảy ra 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Click để xem tất cả câu hỏi có liên quan tới phương trình 4FeS2 + 11O2 → 2Fe2O3 + 8SO2Câu 1. Thí nghiệm
Một chén sứ có khối lượng m1 gam. Cho vào chén một hợp chất X, cân lại thấy có khối lượng m2 gam. Nung chén đó trong không khí đến khối lượng không đổi, rồi để nguội chén, cân lại thấy nặng m3 gam, biết m1 < m3 < m2. Có bao nhiêu chất trong các chất cho sau đây thỏa mãn thí nghiệm trên: NaHCO3, NaNO3, NH4Cl, I2, K2CO3, Fe, Fe(OH)2 và FeS2 ?
A. 5
B. 6
C. 4
D. 3
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 2
Phương Trình Kết Quả Số #3
Cách viết phương trình đã cân bằng
 |  | .jpg) | |||
| O2 | + | 2SO2 | ↔ | 2SO3 | |
| oxi | lưu hùynh dioxit | sulfuarơ | |||
| Sulfur đioxit | Sulfur trioxit | ||||
| (khí) | (khí) | (lỏng) | |||
| (không màu) | (không màu) | (không màu) | |||
| 1 | 2 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình O2 + 2SO2 → 2SO3
O2 + 2SO2 → 2SO3 là Phản ứng oxi-hoá khử, O2 (oxi) phản ứng với SO2 (lưu hùynh dioxit) để tạo ra SO3 (sulfuarơ) dười điều kiện phản ứng là Nhiệt độ: 450°C Xúc tác: V2O5
Điều kiện phản ứng O2 (oxi) tác dụng SO2 (lưu hùynh dioxit) là gì ?
Nhiệt độ: 450°C Xúc tác: V2O5
Làm cách nào để O2 (oxi) tác dụng SO2 (lưu hùynh dioxit) xảy ra phản ứng?
so2 bị oxi hóa bởi oxi
Hiện tượng nhận biết nếu phản ứng xảy ra O2 + 2SO2 → 2SO3 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình O2 + 2SO2 → 2SO3
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình O2 + 2SO2 → 2SO3
Click để xem tất cả câu hỏi có liên quan tới phương trình O2 + 2SO2 → 2SO3Câu 1. Cân bằng hóa học
Cho các cân bằng:
1) H2 + I2(rắn) ←→ 2HI
2) N2 + 3H2 ←→ 2NH3
3) H2 + Cl2 ←→ 2HCl
4) 2SO2 (k) + O2 (k) ←→ 2SO3
5) SO2 + Cl2 ←→ SO2Cl2
Khi tăng áp suất chung của cả hệ số cân bằng chuyển dịch theo chiều thuận và
chiều nghịch lần lượt là:
A. 3 và 2
B. 3 và 1
C. 2 và 4
D. 2 và 5
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 4
Phương Trình Kết Quả Số #4
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| H2SO4 | + | Zn | → | H2 | + | ZnSO4 | |
| axit sulfuric | kẽm | hidro | kẽm sulfat | ||||
| Sulfuric acid; | Hydrogen | Zinc sulfate | |||||
| (dd) | (rắn) | (khí) | (dd) | ||||
| (không màu) | (trắng xanh) | (không màu) | (không màu) | ||||
| Axit | Muối | ||||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình H2SO4 + Zn → H2 + ZnSO4
H2SO4 + Zn → H2 + ZnSO4 là Phản ứng oxi-hoá khửPhản ứng thế, H2SO4 (axit sulfuric) phản ứng với Zn (kẽm) để tạo ra H2 (hidro), ZnSO4 (kẽm sulfat) dười điều kiện phản ứng là Không có
Điều kiện phản ứng H2SO4 (axit sulfuric) tác dụng Zn (kẽm) là gì ?
Không có
Làm cách nào để H2SO4 (axit sulfuric) tác dụng Zn (kẽm) xảy ra phản ứng?
Cho một ít kim loại Zn vào đáy ống nghiệm, thêm vào ống 1-2 ml dung dịch axit.
Hiện tượng nhận biết nếu phản ứng xảy ra H2SO4 + Zn → H2 + ZnSO4 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình H2SO4 + Zn → H2 + ZnSO4
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình H2SO4 + Zn → H2 + ZnSO4
Click để xem tất cả câu hỏi có liên quan tới phương trình H2SO4 + Zn → H2 + ZnSO4Câu 1. Ứng dụng
Trong các hiện tượng thực hành dưới đây, hiện tượng nào miêu tả không chính xác.
A. Cho mẩu Na vào dung dịch đựng FeCl3 thấy có khí thoát ra đồng thời có kết tủa màu nâu đỏ.
B. Thêm dung dịch NH3 dư vào dung dịch AlCl3 thấy có kết tủa, sục khí CO2 dư vào ống nghiệm chứa kết tủa trên thấy kết tủa tan
C. Nhúng lá sắt đã đánh sạch gỉ vào dung dịch CuSO4, lá sắt chuyển sang màu đỏ.
D. Thả mẩu kẽm vào hai ống nghiệm đều chứa dung dịch H2SO4. Thêm vào ống nghiệm thứ nhất vài giọt CuSO4 thấy khí thoát ra ở ống nghiệm này nhanh hơn.
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 5
Phương Trình Kết Quả Số #5
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| 2NaOH | + | ZnSO4 | → | Na2SO4 | + | Zn(OH)2 | |
| natri hidroxit | kẽm sulfat | natri sulfat | Kẽm hidroxit | ||||
| Sodium hydroxide | Zinc sulfate | Sodium sulfate | Zinc hydroxide | ||||
| (dung dịch pha loãng) | (rắn) | (rắn) | (kt) | ||||
| (không màu) | (trắng) | (trắng) | (keo trắng) | ||||
| Bazơ | Muối | Muối | Bazơ | ||||
| 2 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2 là Phản ứng trao đổi, NaOH (natri hidroxit) phản ứng với ZnSO4 (kẽm sulfat) để tạo ra Na2SO4 (natri sulfat), Zn(OH)2 (Kẽm hidroxit) dười điều kiện phản ứng là Không có
Điều kiện phản ứng NaOH (natri hidroxit) tác dụng ZnSO4 (kẽm sulfat) là gì ?
Không có
Làm cách nào để NaOH (natri hidroxit) tác dụng ZnSO4 (kẽm sulfat) xảy ra phản ứng?
Cho NaOH tác dụng với ZnSO4
Hiện tượng nhận biết nếu phản ứng xảy ra 2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 6
Phương Trình Kết Quả Số #6
Cách viết phương trình đã cân bằng
 |  |  | |||
| Zn(OH)2 | → | H2O | + | ZnO | |
| Kẽm hidroxit | nước | kẽm oxit | |||
| Zinc hydroxide | Kẽm ôxít | ||||
| (bột) | (lỏng) | (rắn) | |||
| (trắng) | (không màu) | (trắng) | |||
| Bazơ | |||||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Zn(OH)2 → H2O + ZnO
Zn(OH)2 → H2O + ZnO là Phương Trình Phản Ứng Hóa Học, Zn(OH)2 (Kẽm hidroxit) để tạo ra H2O (nước), ZnO (kẽm oxit) dười điều kiện phản ứng là Nhiệt độ: 100 - 250°C
Điều kiện phản ứng Zn(OH)2 (Kẽm hidroxit) là gì ?
Nhiệt độ: 100 - 250°C
Làm cách nào để Zn(OH)2 (Kẽm hidroxit) xảy ra phản ứng?
phân hủy Zn(OH)2.
Hiện tượng nhận biết nếu phản ứng xảy ra Zn(OH)2 → H2O + ZnO là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), ZnO (kẽm oxit) (trạng thái: rắn) (màu sắc: trắng), được sinh ra
Hoặc bạn phải quan sát chất tham gia Zn(OH)2 (Kẽm hidroxit) (trạng thái: bột) (màu sắc: trắng), biến mất.
Giải thích chi tiết về các phân loại của phương trình Zn(OH)2 → H2O + ZnO
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiHãy chia sẽ cho bạn bè nếu nếu tài liệu này là hữu ích nhé
Chia sẻ qua facebook
Hoặc chia sẽ link trực tiếp:
http://v1.phuongtrinhhoahoc.com/chuoi-phuong-trinh-hoa-hoc/chuoi-phan-ung-vo-co-33Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
















