|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
Cl2 + H2 = 2HCl | Cân Bằng Phương Trình Hóa Học
Cl2 | clo | khí + H2 | hidro | khí = HCl | axit clohidric | khí, Điều kiện Nhiệt độ cháy trong H2 Cl2 hoặc ở nhiệt độ phòng, Điều kiện khác có ánh sáng
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình Cl2 + H2 → 2HCl
- Điều kiện phản ứng để Cl2 (clo) tác dụng H2 (hidro) là gì ?
- Làm cách nào để Cl2 (clo) tác dụng H2 (hidro)?
- Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + H2 → 2HCl là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Cl2 + H2 → 2HCl ?
- Giải thích chi tiết về các phân loại của phương trình Cl2 + H2 → 2HCl
- Chuỗi phương trình hóa học có sử dụng Cl2 + H2 → 2HCl
Cách viết phương trình đã cân bằng
 |  |  | |||
| Cl2 | + | H2 | → | 2HCl | |
| clo | hidro | axit clohidric | |||
| Chlorine | Hydrogen | ||||
| (khí) | (khí) | (khí) | |||
| (vàng lục) | (không màu) | (không màu) | |||
| Axit | |||||
| 71 | 2 | 36 | |||
| 1 | 1 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình Cl2 + H2 → 2HCl
Cl2 + H2 → 2HCl là Phản ứng hoá hợpPhản ứng oxi-hoá khử, Cl2 (clo) phản ứng với H2 (hidro) để tạo ra HCl (axit clohidric) dười điều kiện phản ứng là Nhiệt độ: cháy trong H2 Cl2 hoặc ở nhiệt độ phòng Điều kiện khác: có ánh sáng
Điều kiện phản ứng Cl2 (clo) tác dụng H2 (hidro) là gì ?
Nhiệt độ: cháy trong H2 Cl2 hoặc ở nhiệt độ phòng Điều kiện khác: có ánh sáng
Làm cách nào để Cl2 (clo) tác dụng H2 (hidro) xảy ra phản ứng?
đưa hidro đang cháy vào lọ đựng khí clo. Sau phản ứng, cho một ít nước vào lọ lắc nhẹ rồi dùng giấy quỳ tím để thử.
Nếu đang làm bài tập các bạn có thể viết đơn giản là Cl2 (clo) tác dụng H2 (hidro) và tạo ra chất HCl (axit clohidric)
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + H2 → 2HCl là gì ?
Hidro cháy trong khí clo tạo thành khí không màu. Màu vàng lục của khí clo biến mất. giấy quỳ tím hoá đỏ.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Cl2 + H2 → 2HCl
Khi clo đã phản ứng mạnh với hidro tạo thành khí hidro clorua không màu. Khí này tan trong nước tạo thành dung dịch axit clohidric và làm quỳ tím hoá đỏ.
Phương Trình Điều Chế Từ Cl2 Ra HCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Cl2 (clo) ra HCl (axit clohidric)
Xem tất cả phương trình điều chế từ Cl2 (clo) ra HCl (axit clohidric)Phương Trình Điều Chế Từ H2 Ra HCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ H2 (hidro) ra HCl (axit clohidric)
Xem tất cả phương trình điều chế từ H2 (hidro) ra HCl (axit clohidric)Giải thích chi tiết về các phân loại của phương trình Cl2 + H2 → 2HCl
Phản ứng hoá hợp là gì ?
Trong phản ứng hóa hợp, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi. Như vậy, phản ứng hóa hợp có thể là phản ứng oxi hóa - khử hoặc không phải là phản ứng oxi hóa - khử. Phản ứng hoá học là loại phản ứng xuất hiện nhiều trong chương trình Hoá trung học cơ sở, phổ thông cho tới Ôn Thi Đại Học.
Xem tất cả phương trình Phản ứng hoá hợp
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Cl2 + H2 → 2HCl
Click để xem tất cả câu hỏi có liên quan tới phương trình Cl2 + H2 → 2HClCâu 1. Cân bằng hóa học
Cho các cân bằng:
1) H2 + I2(rắn) ←→ 2HI
2) N2 + 3H2 ←→ 2NH3
3) H2 + Cl2 ←→ 2HCl
4) 2SO2 (k) + O2 (k) ←→ 2SO3
5) SO2 + Cl2 ←→ SO2Cl2
Khi tăng áp suất chung của cả hệ số cân bằng chuyển dịch theo chiều thuận và
chiều nghịch lần lượt là:
A. 3 và 2
B. 3 và 1
C. 2 và 4
D. 2 và 5
Xem đáp án câu 1
Câu 2. Bài toán hiệu suất
Cho 11,2l H2 (đktc) tác dụng với 0,45 mol Cl2 thu được 0,6 mol HCl . Tính hiệu suất phản ứng .
A. 66,67%
B. 34,33%
C. 75%
D. 35%
Xem đáp án câu 2
Câu 3. Flo
Phản ứng nào tác dụng với hidro xảy ra ngay trong bóng tối, ở nhiệt độ rất thấp?
A. H2 + Cl2 --> 2HCl
B. H2 + I2 --> 2HI
C. H2 + F2 --> 2HF
D. H2 + Br2 --> 2HBr
Xem đáp án câu 3
Câu 4. Bài toán liên quan tới tính chất hóa học của clo và hợp chất của clo
Cho 10,0 lít H2 và 6,72 lít Cl2 (đktc) tác dụng với nhau rồi hoà tan sản phẩm vào 385,4 gam nước ta thu được dung dịch X. Lấy 50,000g dung dịch X tác dụng với dung dịch AgNO3 thu được 7,175 gam kết tủa. Hiệu suất phản ứng giữa H2 và Cl2 là:
A. 33,33%
B. 45%
C. 50%
D. 66,67%.
Xem đáp án câu 4
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Chuỗi phương trình hóa học có sử dụng Cl2 + H2 → 2HCl
Chuỗi phản ứng về halogen

Cho MnO2 tác dụng với axit HCl sản phẩm có khí clorua thoát ra, tiếp tục cho clorua tác dụng với hidro sản phẩm tạo thành là HCl. Tiếp theo, để thu được sản phẩm là clorua, chúng ta cho HCl phản ứng với KMnO4, sau đó cho kim loại canxi phản ứng với clorua tạo thành muối CaCl2.
Tiếp tục, cho CaCl2 tác dụng với dung dịch NaOH sản phẩm thu được có Ca(OH)2, sau đó cho Ca(OH)2 phản ứng với clorua sản phẩm tạo thành gồm CaOCl2, H2O
Phương trình liên quan
Có 6 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về halogen
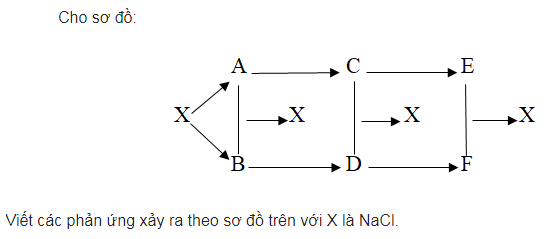
Để tạo ra được sản phẩm là clorua và natri, chúng ta cần điện phân muối ăn NaCl. Sau đó, cho kim loại natri tác dụng với clorua sản phẩm tạo thành là muối ăn NaCl.
Tiếp theo cho natri clorua tác dụng với nước sản phẩm tạo thành có khí thoát ra là khí H2. Sau đó cho khí hidro tác dụng với clorua, sản phẩm tạo thành là HCl.
Cho muối ăn NaOH phản ứng với HCl sản phẩm tạo thành có muối NaCl. Tiếp tục cho dung dịch bazo NaOH phản ứng với axit sunfuric sản phẩm tạo thành gồm Na2SO4 và H2O.
Sau đó cho axit HCl phản ứng với bazo Ba(OH)2 thu được BaCl2.
Cuối cùng cho BaCl2 phản ứng với muối natri sunfat thu được kết tủa là BaSO4 và muối ăn NaCl.
Phương trình liên quan
Có 8 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về halogen

a,
Đầu tiên, cho MnO2 phản ứng với HCl tạo thành muối MnCl2 và có khí clo thoát ra.
Tiếp theo, cho H2 phản ứng với Cl2 tạo thành HCl
Kế tiếp, cho KMnO4 phản ứng với HCl sản phẩm thu được KCl, muối MnCl2 và có khí clo thoát ra.
Cho Ca tác dụng với Cl2 tạo thành muối CaCl2
Sau đó, cho CaCl2 tác dụng NaOH tạo thành Ca(OH)2và muối NaCl
Cuối cùng, cho Cl2 tác dụng với Ca(OH)2 tạo thành CaOCl2 và H2O
b,
Đầu tiên, cho KMnO4 tác dụng với HCl tạo thành KCl và muối MnCl2 có khí clo thoát ra.
Sau đó, cho Cl2 tác dụng với K thu được muối KCl
Nhiệt phân muối KCl thu được K và có khí thoát ra Cl2
Cho clo phản ứng với H2O thu được HCl và HClO
Kế tiếp, cho Cl2 tác dụng với NaOH sản phẩm thu được gồm có NaCl và NaClO có H2O thoát ra.
Cho muối NaClO phản ứng với HCl sản phẩm tạo thành có khí Cl2 , muối NaCl và H2O
Tiếp theo, cho NaCl tác dụng với H2O kết quả thu được là khí H2 , NaOH và khí Cl2
Cuối cùng, cho Fe tác dụng với Cl2 sản phẩm tạo thành là muối FeCl3
Phương trình liên quan
Có 13 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về phi kim
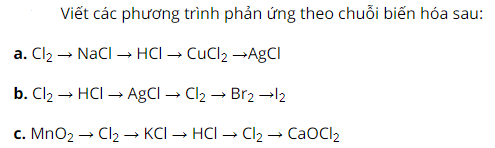
a.
Đầu tiên, cho Cl2 phản ứng với Na tạo thành muối màu trắng NaCl
Sau đó, cho NaCl tác dụng với H2SO4 đặc tạo thành muối Na2SO4 và HCl
Tiếp theo, cho HCl phản ứng với CuO tạo thành muối CuCl2 và H2O
Cuối cùng, cho CuCl2 tác dụng với AgNO3 tạo thành muối Cu(NO3)2 và AgCl↓ kết tủa trắng.
b.
Cho Cl2 phản ứng với H2 trong điều kiện ánh sáng, sẽ thu được HCl
Tiếp theo, cho HCl phản ứng AgNO3 tạo thành AgCl↓ kết tủa trắng và HNO3
Sau đó, điện phân AgCl kết quả thu được Ag ↓ kết tủa trắng và có khí thoát ra Cl2
Tiếp theo, cho Cl2 tác dụng NaBr kết quả thu được muối NaCl và Br2
Cuối cùng, cho Br2phản ứng với NaI tạo thành muối NaBr và I2
c.
Đầu tiên, cho MnO2 phản ứng với HCl tạo thành muối MnCl2 và có khí bay ra Cl2
Sau đó, cho Cl2tác dụng K thu được muối KCl
Tiếp theo, cho KCl tác dụng H2SO4 đặc, nóng thu được muối K2SO4 và có khí bay ra HCl↑
Kế tiếp, cho HCl phản ứng với KClO3 sản phẩm tạo thành muối KCl và có khí Cl2 ↑ thoát ra.
Cuối cùng, cho Cl2 phản ứng Ca(OH)2 tạo thành CaOCl2 và H2O
Phương trình liên quan
Có 14 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi các phương trình phản ứng về hidro
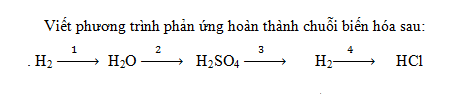
Đốt cháy khí hidro trong không khí sản phẩm tạo thành là nước.
Cho lưu huỳnh trioxit (oxit axit) tác dụng với nước tạo ra axit sunfuric.
Hòa tan thanh kẽm bằng dung dịch axit sunfuric sản phẩm tạo thành có khí hidro thoát ra.
Cuối cùng cho hidro phản ứng với khí clo sản phẩm tạo thành khí không màu là HCl.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng của halogen clo

Cho clo phản ứng với hidro trong điều kiện có ánh sáng, sản phẩm tạo thành là khí HCl.
Sau đó cho HCl phản ứng với MnO2 với nhiệt độ sản phẩm tạo thành có khí màu vàng xanh, mùi xốc thoát ra là clo.
Tiếp tục đun nóng clo với natri tạo thành muối natri clorua.
Điện phân nóng chảy muối natri clorua sản phẩm tạo thành có khí màu vàng thoát ra là clo.
Tiếp theo, hòa tan HCl với dung dịch NaOH tạo thành muối NaCl.
Đun nóng muối natri clorua với axit sunfurit ở nhiệt độ 500 độ C tạo thành HCl.
Phương trình liên quan
Có 6 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phương trình phản ứng của clo và kim loại sắt

Đốt cháy clo với hidro trong điều kiện có ánh sáng tạo thành HCl.
Hòa tan kim loại sắt với HCl tạo thành muối sắt (II) clorua.
Tiếp tục cho muối FeCl2 phản ứng với AgNO3 sản phẩm tạo thành có hiện tượng kết tủa là AgCl.
Nhiệt phân muối bạc clorua sản phẩm tạo thành có khí màu vàng thoát ra là clo.
Sục khí clo qua dung dịch nước vôi trong thu được clorua vôi.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về phi kim

a.
Cho kim loại natri tác dụng với clorua thu được muối ăn NaCl.
Cho muối ăn này tác dụng với axit sunfuric đặc ta thu được sản phẩm muối natri sunfat và axit clohidric.
Sau đó cho axit HCl tác dụng với CuO, sản phẩm tạo thành là CuCl2.
Tiếp tục cho muối CuCl2 phản ứng với bạc nitrat thu được sản phẩm kết tủa AgCl và muối đồng nitrat
b.
Cho clo tác dụng với hidro với điều kiện có ánh sáng, sản phẩm tạo thành là HCl.
Tiếp tục cho HCl tác dụng với bạc nitrat sản phẩm thu được là bạc clorua kết tủa trắng.
Sau đó, điện phân AgCl thu được khí clo. Cho clo tác dụng với muối NaBr thu được sản phẩm là brom.
Cuối cùng cho brom tác dụng với muối NaI sản phẩm thu được gồm NaBr và iot.
c.
Đầu tiên, chúng ta sẽ cho MnO2 tác dụng với dung dịch axit HCl để thu được sản phẩm là clorua, sau đó cho clorua phản ứng với kim loại K thu được muối KCl.
Tiếp tục cho muối KCl tác dụng với axit H2SO4 đặc nóng thu được khí HCl.
Sau đó cho HCl phản ứng với muối KClO3 sản phẩm thu được có khí clotua thoát ra.
Cuối cùng cho khí clorua sục qua dung dịch Ca(OH)2 sàn phẩm thu được gồm CaOCl2 và nước.
Phương trình liên quan
Có 14 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
chuỗi phương trình phản ứng hóa học 8
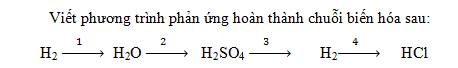
Đầu tiên cho H2 phản ứng với oxi thu được nước.
Tiếp theo, cho nước tác dụng với SO3 thu được H2SO4.
Kế tiếp, cho H2SO4 phản ứng với bari thu được muối và giải phóng hidro.
Cuối cùng, cho hidro tác dụng với clo thu được HCl.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Bài Viết Hóa Học Liên Quan
Bài 23. Hiđro clorua – Axit clohiđric và muối clorua
Axit clohidric có đầy đủ tính chất của một axit hay không? Nó có những tính chất nào khác so với các axit thông thường? Nhận biết ion Cl bằng cách nào? Chúng ta cùng nhau tìm hiểu nội dung bài giảng Hiđro clorua - Axit clohiđric và muối clorua để làm rõ các vấn đề nêu trên.
Bài 22. Clo
Nội dung bài giảng Clo tìm hiểu về Tính chất vật lí, trạng thái tự nhiên, ứng dụng của clo, phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. Kiến thức trọng tâm: Tính chất hoá học cơ bản của clo là phi kim mạnh, có tính oxi hoá mạnh (tác dụng với kim loại, hiđro), Clo còn thể hiện tính khử
Chương 4 Phản ứng hóa học Bài 25. Phản ứng oxi hóa - khử
Thế nào là chất oxi hóa, chất khử, sự oxi hóa, sự khử, phản ứng oxi hóa khử?
Bài 30. Clo
Clo có những tính chất vật lí và hóa học đặc trưng nào? Hãy xem xét những tính chất đó theo lí thuyết đã học.
Bài 26. Clo
Bài giảng Clo đi sâu tìm hiểu về Tính chất vật lí của clo; Clo có một số tính chất chung của phi kim(tác dụng với kim loại, với hiđro), clo còn tác dụng với nước và dung dịch bazơ, clo là phi kim hoạtđộng mạnh; Phương pháp điều chế clo trong công nghiệp, trong phòng thí nghiệm; Một số ứng dụng, thu khí clo trong công nghiệp, trong phòng thí nghiệm.
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Bài học liên quan
Các bài học trong sách giáo khoa có sử dụng phương trình hóa học này:
Bài 23. Hiđro clorua – Axit clohiđric và muối clorua" Bài 22. Clo" Chương 4 Phản ứng hóa học Bài 25. Phản ứng oxi hóa - khử" Bài 30. Clo" Bài 26. Clo"Phương trình sản xuất ra Cl2 (clo)
(chlorine)
2H2O + 2NaCl → Cl2 + H2 + 2NaOH BaCl2 → Cl2 + Ba CuCl2 → Cl2 + Cu Tổng hợp tất cả phương trình điều chế ra Cl2Phương trình sản xuất ra H2 (hidro)
(hydrogen)
C6H12 → C6H6 + H2 C4H10 → CH3CH=CHCH3 + H2 2H2O + 2NaCl → Cl2 + H2 + 2NaOH Tổng hợp tất cả phương trình điều chế ra H2Phương trình sử dụng HCl (axit clohidric) là chất sản phẩm
(hydrogen chloride)
Fe + 2HCl → FeCl2 + H2 HCl + NaOH → H2O + NaCl 2HCl + Zn → H2 + ZnCl2 Tổng hợp tất cả phương trình có HCl tham gia phản ứng















