Chuỗi phản ứng về halogen
Chuỗi phản ứng về halogen lớp 10 THPT
Chuỗi phản ứng về halogen

a,
Đầu tiên, cho MnO2 phản ứng với HCl tạo thành muối MnCl2 và có khí clo thoát ra.
Tiếp theo, cho H2 phản ứng với Cl2 tạo thành HCl
Kế tiếp, cho KMnO4 phản ứng với HCl sản phẩm thu được KCl, muối MnCl2 và có khí clo thoát ra.
Cho Ca tác dụng với Cl2 tạo thành muối CaCl2
Sau đó, cho CaCl2 tác dụng NaOH tạo thành Ca(OH)2và muối NaCl
Cuối cùng, cho Cl2 tác dụng với Ca(OH)2 tạo thành CaOCl2 và H2O
b,
Đầu tiên, cho KMnO4 tác dụng với HCl tạo thành KCl và muối MnCl2 có khí clo thoát ra.
Sau đó, cho Cl2 tác dụng với K thu được muối KCl
Nhiệt phân muối KCl thu được K và có khí thoát ra Cl2
Cho clo phản ứng với H2O thu được HCl và HClO
Kế tiếp, cho Cl2 tác dụng với NaOH sản phẩm thu được gồm có NaCl và NaClO có H2O thoát ra.
Cho muối NaClO phản ứng với HCl sản phẩm tạo thành có khí Cl2 , muối NaCl và H2O
Tiếp theo, cho NaCl tác dụng với H2O kết quả thu được là khí H2 , NaOH và khí Cl2
Cuối cùng, cho Fe tác dụng với Cl2 sản phẩm tạo thành là muối FeCl3
Tóm Tắt Phương Trình Liên Quan
Có 13 phương trình phản ứng hóa học liên quan tới chuỗi này.
Đánh giá
Chi Tiết Phương Trình Liên Quan
Xin lưu ý đây chỉ là phương trình chúng tôi đề nghị, bạn hoàn toàn có thể dùng các phương trình thay thể thỏa điều kiệm của chuỗi
Chi Tiết Phương Trình Số 1
Phương Trình Kết Quả Số #2
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| 4HCl | + | MnO2 | → | Cl2 | + | 2H2O | + | MnCl2 | |
| axit clohidric | Mangan oxit | clo | nước | Mangan(II) diclorua | |||||
| Chlorine | |||||||||
| (dd đặc) | (rắn) | (khí) | (lỏng) | (dd) | |||||
| (đen) | (vàng lục) | (không màu) | (không màu) | ||||||
| Axit | Muối | ||||||||
| 4 | 1 | 1 | 2 | 1 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 4HCl + MnO2 → Cl2 + 2H2O + MnCl2
4HCl + MnO2 → Cl2 + 2H2O + MnCl2 là Phản ứng oxi-hoá khử, HCl (axit clohidric) phản ứng với MnO2 (Mangan oxit) để tạo ra Cl2 (clo), H2O (nước), MnCl2 (Mangan(II) diclorua) dười điều kiện phản ứng là Nhiệt độ: nhiệt độ
Điều kiện phản ứng HCl (axit clohidric) tác dụng MnO2 (Mangan oxit) là gì ?
Nhiệt độ: nhiệt độ
Làm cách nào để HCl (axit clohidric) tác dụng MnO2 (Mangan oxit) xảy ra phản ứng?
Cho MnO2 tác dụng với dung dịch HCl.
Hiện tượng nhận biết nếu phản ứng xảy ra 4HCl + MnO2 → Cl2 + 2H2O + MnCl2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Click để xem tất cả câu hỏi có liên quan tới phương trình 4HCl + MnO2 → Cl2 + 2H2O + MnCl2Câu 1. Phản ứng hóa học
Cho các phản ứng sau:
MnO2 + HCl (đặc) (t0) → Khí X + ... (1);
Na2SO3 + H2SO4 (đặc) (t0)→ Khí Y + ... (2);
NH4Cl + NaOH (t0) → Khí Z + ... (3);
NaCl (r) + H2SO4 (đặc) (t0) → Khí G + ... (4);
Cu + HNO3 (đặc) (t0) → Khí E + ... (5);
FeS + HCl (t0) → Khí F + ... (6);
Những khí tác dụng được với NaOH (trong dung dịch) ở điều kiện thường là:
A. X, Y, Z, G.
B. X, Y, G.
C. X, Y, G, E, F.
D. X, Y, Z, G, E, F.
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 2
Phương Trình Kết Quả Số #3
Cách viết phương trình đã cân bằng
 |  |  | |||
| Cl2 | + | H2 | → | 2HCl | |
| clo | hidro | axit clohidric | |||
| Chlorine | Hydrogen | ||||
| (khí) | (khí) | (khí) | |||
| (vàng lục) | (không màu) | (không màu) | |||
| Axit | |||||
| 1 | 1 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Cl2 + H2 → 2HCl
Cl2 + H2 → 2HCl là Phản ứng hoá hợpPhản ứng oxi-hoá khử, Cl2 (clo) phản ứng với H2 (hidro) để tạo ra HCl (axit clohidric) dười điều kiện phản ứng là Nhiệt độ: cháy trong H2 Cl2 hoặc ở nhiệt độ phòng Điều kiện khác: có ánh sáng
Điều kiện phản ứng Cl2 (clo) tác dụng H2 (hidro) là gì ?
Nhiệt độ: cháy trong H2 Cl2 hoặc ở nhiệt độ phòng Điều kiện khác: có ánh sáng
Làm cách nào để Cl2 (clo) tác dụng H2 (hidro) xảy ra phản ứng?
đưa hidro đang cháy vào lọ đựng khí clo. Sau phản ứng, cho một ít nước vào lọ lắc nhẹ rồi dùng giấy quỳ tím để thử.
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + H2 → 2HCl là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình Cl2 + H2 → 2HCl
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Cl2 + H2 → 2HCl
Click để xem tất cả câu hỏi có liên quan tới phương trình Cl2 + H2 → 2HClCâu 1. Cân bằng hóa học
Cho các cân bằng:
1) H2 + I2(rắn) ←→ 2HI
2) N2 + 3H2 ←→ 2NH3
3) H2 + Cl2 ←→ 2HCl
4) 2SO2 (k) + O2 (k) ←→ 2SO3
5) SO2 + Cl2 ←→ SO2Cl2
Khi tăng áp suất chung của cả hệ số cân bằng chuyển dịch theo chiều thuận và
chiều nghịch lần lượt là:
A. 3 và 2
B. 3 và 1
C. 2 và 4
D. 2 và 5
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 3
Phương Trình Kết Quả Số #4
Cách viết phương trình đã cân bằng
 |  |  |  |  |  | ||||||
| 16HCl | + | 2KMnO4 | → | 5Cl2 | + | 8H2O | + | 2KCl | + | 2MnCl2 | |
| axit clohidric | kali pemanganat | clo | nước | kali clorua | Mangan(II) diclorua | ||||||
| Kali manganat(VII) | Chlorine | Kali clorua | |||||||||
| (lỏng) | (rắn) | (khí) | (lỏng) | (rắn) | (rắn) | ||||||
| (không màu) | (đen) | (không màu) | (không màu) | (trắng) | |||||||
| Axit | Muối | Muối | Muối | ||||||||
| 16 | 2 | 5 | 8 | 2 | 2 | Hệ số | |||||
| Nguyên - Phân tử khối (g/mol) | |||||||||||
| Số mol | |||||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2
16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2 là Phương Trình Phản Ứng Hóa Học, HCl (axit clohidric) phản ứng với KMnO4 (kali pemanganat) để tạo ra Cl2 (clo), H2O (nước), KCl (kali clorua), MnCl2 (Mangan(II) diclorua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng HCl (axit clohidric) tác dụng KMnO4 (kali pemanganat) là gì ?
Không có
Làm cách nào để HCl (axit clohidric) tác dụng KMnO4 (kali pemanganat) xảy ra phản ứng?
Cho KMnO4 tác dụng với dung dịch HCl.
Hiện tượng nhận biết nếu phản ứng xảy ra 16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2
Click để xem tất cả câu hỏi có liên quan tới phương trình 16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2Câu 1. Phản ứng hóa học
Cho các phản ứng sau:
4HCl + MnO2 →MnCl2 + Cl2 + 2H2O;
2HCl + Fe → FeCl2 + H2;
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 +3Cl2 + 7H2O;
6HCl + 2Al → 2AlCl3 + 3H2O;
16HCl + 2KMnO4 → 2KCl+2MnCl2 + 5Cl2 + 8H2O;
Số phản ứng trong đó HCl thể hiện tính khử là:
A. 4
B. 1
C. 3
D. 2
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 4
Phương Trình Kết Quả Số #5
Cách viết phương trình đã cân bằng
 |  |  | |||
| Ca | + | Cl2 | → | CaCl2 | |
| canxi | clo | Canxi diclorua | |||
| Calcium | Chlorine | calcium chloride | |||
| (rắn) | (khí) | (rắn) | |||
| (trắng) | |||||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Ca + Cl2 → CaCl2
Ca + Cl2 → CaCl2 là Phản ứng oxi-hoá khử, Ca (canxi) phản ứng với Cl2 (clo) để tạo ra CaCl2 (Canxi diclorua) dười điều kiện phản ứng là Nhiệt độ: nhiệt độ phòng
Điều kiện phản ứng Ca (canxi) tác dụng Cl2 (clo) là gì ?
Nhiệt độ: nhiệt độ phòng
Làm cách nào để Ca (canxi) tác dụng Cl2 (clo) xảy ra phản ứng?
Ca tác dụng với clo.
Hiện tượng nhận biết nếu phản ứng xảy ra Ca + Cl2 → CaCl2 là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm CaCl2 (Canxi diclorua) (trạng thái: rắn) (màu sắc: trắng), được sinh ra
Hoặc bạn phải quan sát chất tham gia Ca (canxi) (trạng thái: rắn), Cl2 (clo) (trạng thái: khí), biến mất.
Giải thích chi tiết về các phân loại của phương trình Ca + Cl2 → CaCl2
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 5
Phương Trình Kết Quả Số #6
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| 2NaOH | + | CaCl2 | → | Ca(OH)2 | + | 2NaCl | |
| natri hidroxit | Canxi diclorua | canxi hidroxit hoặc tôi vôi | Natri Clorua | ||||
| Sodium hydroxide | calcium chloride | natri clorua | |||||
| (rắn) | (rắn) | (bột) | (rắn) | ||||
| (trắng) | (trắng) | (trắng) | (trắng) | ||||
| Bazơ | Bazơ | Muối | |||||
| 2 | 1 | 1 | 2 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2NaOH + CaCl2 → Ca(OH)2 + 2NaCl
2NaOH + CaCl2 → Ca(OH)2 + 2NaCl là Phương Trình Phản Ứng Hóa Học, NaOH (natri hidroxit) phản ứng với CaCl2 (Canxi diclorua) để tạo ra Ca(OH)2 (canxi hidroxit hoặc tôi vôi), NaCl (Natri Clorua) dười điều kiện phản ứng là Nhiệt độ: Nhiệt độ.
Điều kiện phản ứng NaOH (natri hidroxit) tác dụng CaCl2 (Canxi diclorua) là gì ?
Nhiệt độ: Nhiệt độ.
Làm cách nào để NaOH (natri hidroxit) tác dụng CaCl2 (Canxi diclorua) xảy ra phản ứng?
cho NaOH tác dụng với CaCl2.
Hiện tượng nhận biết nếu phản ứng xảy ra 2NaOH + CaCl2 → Ca(OH)2 + 2NaCl là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm Ca(OH)2 (canxi hidroxit hoặc tôi vôi) (trạng thái: bột) (màu sắc: trắng), NaCl (Natri Clorua) (trạng thái: rắn) (màu sắc: trắng), được sinh ra
Hoặc bạn phải quan sát chất tham gia NaOH (natri hidroxit) (trạng thái: rắn) (màu sắc: trắng), CaCl2 (Canxi diclorua) (trạng thái: rắn) (màu sắc: trắng), biến mất.
Giải thích chi tiết về các phân loại của phương trình 2NaOH + CaCl2 → Ca(OH)2 + 2NaCl
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 6
Phương Trình Kết Quả Số #7
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| Ca(OH)2 | + | Cl2 | → | CaOCl2 | + | H2O | |
| canxi hidroxit hoặc tôi vôi | clo | Clorua vôi | nước | ||||
| Chlorine | |||||||
| (dd) | (khí) | (chất bột) | (lỏng) | ||||
| (trắng) | |||||||
| Bazơ | Muối | ||||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Ca(OH)2 + Cl2 → CaOCl2 + H2O
Ca(OH)2 + Cl2 → CaOCl2 + H2O là Phản ứng oxi-hoá khử, Ca(OH)2 (canxi hidroxit hoặc tôi vôi) phản ứng với Cl2 (clo) để tạo ra CaOCl2 (Clorua vôi), H2O (nước) dười điều kiện phản ứng là Nhiệt độ: 30°C
Điều kiện phản ứng Ca(OH)2 (canxi hidroxit hoặc tôi vôi) tác dụng Cl2 (clo) là gì ?
Nhiệt độ: 30°C
Làm cách nào để Ca(OH)2 (canxi hidroxit hoặc tôi vôi) tác dụng Cl2 (clo) xảy ra phản ứng?
Khi cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở 30 độ C ta thu được clorua vôi.
Hiện tượng nhận biết nếu phản ứng xảy ra Ca(OH)2 + Cl2 → CaOCl2 + H2O là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình Ca(OH)2 + Cl2 → CaOCl2 + H2O
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Ca(OH)2 + Cl2 → CaOCl2 + H2O
Click để xem tất cả câu hỏi có liên quan tới phương trình Ca(OH)2 + Cl2 → CaOCl2 + H2OCâu 1. Phản ứng hóa học
Tiến hành các thí nghiệm sau:
(1). Cho Fe2O3 vào dung dịch HI dư.
(2). Cho dung dịch HCl vào dung dịch Fe(NO3)2
(3). Sục khí SO2 vào dung dịch KMnO4.
(4). Sục khí CO2 vào dung dịch nước Javen.
(5). Cho kim loại Be vào H2O.
(6). Sục khí Cl2 vào dung dịch nước Br2.
(7). Cho kim loại Al vào dung dịch HNO3 nguội.
(8). NO2 tác dụng với nước có mặt oxi.
(9). Clo tác dụng sữa vôi (30 độ C).
(10). Lấy thanh Fe ngâm trong dung dịch H2SO4 đặc nguội, rồi lấy ra cho tiếp vào dung dịch HCl loãng.
Số thí nghiệm có phản ứng oxi hóa – khử xảy ra là:
A. 8
B. 6
C. 5
D. 7
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 7
Phương Trình Kết Quả Số #8
Cách viết phương trình đã cân bằng
 |  |  | |||
| Cl2 | + | 2K | → | 2KCl | |
| clo | kali | kali clorua | |||
| Chlorine | Potassium; | Kali clorua | |||
| (khí) | (rắn) | (rắn) | |||
| (vàng lục) | (trắng bạc) | (trắng) | |||
| Muối | |||||
| 1 | 2 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Cl2 + 2K → 2KCl
Cl2 + 2K → 2KCl là Phản ứng oxi-hoá khử, Cl2 (clo) phản ứng với K (kali) để tạo ra KCl (kali clorua) dười điều kiện phản ứng là Nhiệt độ: nhiệt độ phòng
Điều kiện phản ứng Cl2 (clo) tác dụng K (kali) là gì ?
Nhiệt độ: nhiệt độ phòng
Làm cách nào để Cl2 (clo) tác dụng K (kali) xảy ra phản ứng?
cho clo tác dụng với kali
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + 2K → 2KCl là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm KCl (kali clorua) (trạng thái: rắn) (màu sắc: trắng), được sinh ra
Hoặc bạn phải quan sát chất tham gia Cl2 (clo) (trạng thái: khí) (màu sắc: vàng lục), K (kali) (trạng thái: rắn) (màu sắc: trắng bạc), biến mất.
Giải thích chi tiết về các phân loại của phương trình Cl2 + 2K → 2KCl
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 8
Phương Trình Kết Quả Số #9
Cách viết phương trình đã cân bằng
 |  |  | |||
| 2KCl | → | Cl2 | + | 2K | |
| kali clorua | clo | kali | |||
| Kali clorua | Chlorine | Potassium; | |||
| (rắn) | (khí) | (rắn) | |||
| (trắng) | (vàng xanh) | (trắng bạc) | |||
| Muối | |||||
| 2 | 1 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2KCl → Cl2 + 2K
2KCl → Cl2 + 2K là Phương Trình Phản Ứng Hóa Học, KCl (kali clorua) để tạo ra Cl2 (clo), K (kali) dười điều kiện phản ứng là Không có
Điều kiện phản ứng KCl (kali clorua) là gì ?
Không có
Làm cách nào để KCl (kali clorua) xảy ra phản ứng?
Điện phân nóng chảy KCl.
Hiện tượng nhận biết nếu phản ứng xảy ra 2KCl → Cl2 + 2K là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2KCl → Cl2 + 2K
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 2KCl → Cl2 + 2K
Click để xem tất cả câu hỏi có liên quan tới phương trình 2KCl → Cl2 + 2KCâu 1. Phương pháp điện phân dung dịch muối
Dãy kim loại đều có thể điều chế bằng phương pháp điện phân dung dịch muối của chúng là
A. Na, Cu
B. Ca, Zn
C. Fe, Ag
D. K, Al
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 9
Phương Trình Kết Quả Số #10
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| Cl2 | + | H2O | → | HCl | + | HClO | |
| clo | nước | axit clohidric | Hypochlorous acid | ||||
| Chlorine | axit hipoclorơ, cloranol, hyđrôxítôclorin | ||||||
| (khí) | (lỏng) | (dd) | (lỏng) | ||||
| (vàng xanh) | (không màu) | (không màu) | (không màu) | ||||
| Axit | Axit | ||||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Cl2 + H2O → HCl + HClO
Cl2 + H2O → HCl + HClO là Phương Trình Phản Ứng Hóa Học, Cl2 (clo) phản ứng với H2O (nước) để tạo ra HCl (axit clohidric), HClO (Hypochlorous acid) dười điều kiện phản ứng là Không có
Điều kiện phản ứng Cl2 (clo) tác dụng H2O (nước) là gì ?
Không có
Làm cách nào để Cl2 (clo) tác dụng H2O (nước) xảy ra phản ứng?
cho clo vào nước.
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + H2O → HCl + HClO là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm HCl (axit clohidric) (trạng thái: dd) (màu sắc: không màu), HClO (Hypochlorous acid) (trạng thái: lỏng) (màu sắc: không màu), được sinh ra
Hoặc bạn phải quan sát chất tham gia Cl2 (clo) (trạng thái: khí) (màu sắc: vàng xanh), H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), biến mất.
Giải thích chi tiết về các phân loại của phương trình Cl2 + H2O → HCl + HClO
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 10
Phương Trình Kết Quả Số #11
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| Cl2 | + | 2NaOH | → | H2O | + | NaCl | + | NaClO | |
| clo | natri hidroxit | nước | Natri Clorua | Natri hypoclorit | |||||
| Chlorine | Sodium hydroxide | natri clorua | Sodium hypochlorite | ||||||
| (khí) | (dd) | (lỏng) | (dd) | (dd) | |||||
| (vàng lục) | (không màu) | (không màu) | (không màu) | ||||||
| Bazơ | Muối | Muối | |||||||
| 1 | 2 | 1 | 1 | 1 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
Cl2 + 2NaOH → H2O + NaCl + NaClO là Phản ứng oxi-hoá khử, Cl2 (clo) phản ứng với NaOH (natri hidroxit) để tạo ra H2O (nước), NaCl (Natri Clorua), NaClO (Natri hypoclorit) dười điều kiện phản ứng là Không có
Điều kiện phản ứng Cl2 (clo) tác dụng NaOH (natri hidroxit) là gì ?
Không có
Làm cách nào để Cl2 (clo) tác dụng NaOH (natri hidroxit) xảy ra phản ứng?
Dẫn khí clo vào ống nghiệm đựng dung dịch NaOH. Nhỏ 1-2 giọt dung dịch vừa tạo thành mẩi giấy quỳ tím.
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + 2NaOH → H2O + NaCl + NaClO là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
Click để xem tất cả câu hỏi có liên quan tới phương trình Cl2 + 2NaOH → H2O + NaCl + NaClOCâu 1. Phản ứng hóa học
Cho các phản ứng sau:
MnO2 + HCl (đặc) (t0) → Khí X + ... (1);
Na2SO3 + H2SO4 (đặc) (t0)→ Khí Y + ... (2);
NH4Cl + NaOH (t0) → Khí Z + ... (3);
NaCl (r) + H2SO4 (đặc) (t0) → Khí G + ... (4);
Cu + HNO3 (đặc) (t0) → Khí E + ... (5);
FeS + HCl (t0) → Khí F + ... (6);
Những khí tác dụng được với NaOH (trong dung dịch) ở điều kiện thường là:
A. X, Y, Z, G.
B. X, Y, G.
C. X, Y, G, E, F.
D. X, Y, Z, G, E, F.
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 11
Phương Trình Kết Quả Số #12
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| 2HCl | + | NaClO | → | Cl2 | + | H2O | + | NaCl | |
| axit clohidric | Natri hypoclorit | clo | nước | Natri Clorua | |||||
| Sodium hypochlorite | Chlorine | natri clorua | |||||||
| (dung dịch) | (rắn) | (khí) | (lỏng) | (rắn) | |||||
| (không màu) | (trắng) | (vàng lục) | (không màu) | (trắng) | |||||
| Axit | Muối | Muối | |||||||
| 2 | 1 | 1 | 1 | 1 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2HCl + NaClO → Cl2 + H2O + NaCl
2HCl + NaClO → Cl2 + H2O + NaCl là Phản ứng oxi-hoá khử, HCl (axit clohidric) phản ứng với NaClO (Natri hypoclorit) để tạo ra Cl2 (clo), H2O (nước), NaCl (Natri Clorua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng HCl (axit clohidric) tác dụng NaClO (Natri hypoclorit) là gì ?
Không có
Làm cách nào để HCl (axit clohidric) tác dụng NaClO (Natri hypoclorit) xảy ra phản ứng?
cho axit HCl tác dụng với NaClO
Hiện tượng nhận biết nếu phản ứng xảy ra 2HCl + NaClO → Cl2 + H2O + NaCl là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2HCl + NaClO → Cl2 + H2O + NaCl
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 12
Phương Trình Kết Quả Số #13
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| 2H2O | + | 2NaCl | → | Cl2 | + | H2 | + | 2NaOH | |
| nước | Natri Clorua | clo | hidro | natri hidroxit | |||||
| natri clorua | Chlorine | Hydrogen | Sodium hydroxide | ||||||
| (lỏng) | (dd) | (khí) | (khí) | (dd) | |||||
| (không màu) | (trắng) | (vàng lục) | (không màu) | (không màu) | |||||
| Muối | Bazơ | ||||||||
| 2 | 2 | 1 | 1 | 2 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2H2O + 2NaCl → Cl2 + H2 + 2NaOH
2H2O + 2NaCl → Cl2 + H2 + 2NaOH là Phản ứng oxi-hoá khử, H2O (nước) phản ứng với NaCl (Natri Clorua) để tạo ra Cl2 (clo), H2 (hidro), NaOH (natri hidroxit) dười điều kiện phản ứng là Điều kiện khác: Điện phân có màng ngăn
Điều kiện phản ứng H2O (nước) tác dụng NaCl (Natri Clorua) là gì ?
Điều kiện khác: Điện phân có màng ngăn
Làm cách nào để H2O (nước) tác dụng NaCl (Natri Clorua) xảy ra phản ứng?
điện phân NaCl có màng ngăn.
Hiện tượng nhận biết nếu phản ứng xảy ra 2H2O + 2NaCl → Cl2 + H2 + 2NaOH là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2H2O + 2NaCl → Cl2 + H2 + 2NaOH
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 2H2O + 2NaCl → Cl2 + H2 + 2NaOH
Click để xem tất cả câu hỏi có liên quan tới phương trình 2H2O + 2NaCl → Cl2 + H2 + 2NaOHCâu 1. Bài toán điện phân
Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp), thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1 : 1, tạo ra chất Z tan trong nước. Chất Z là
A. Ca(HCO3)2
B. Na2CO3.
C. NaOH.
D. NaHCO3.
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 13
Phương Trình Kết Quả Số #14
Cách viết phương trình đã cân bằng
 |  | 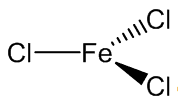 | |||
| 3Cl2 | + | 2Fe | → | 2FeCl3 | |
| clo | sắt | Sắt triclorua | |||
| Chlorine | Iron | Iron(III) chloride | |||
| (khí) | (rắn) | (rắn) | |||
| (vàng lục) | (trắng xám) | (nâu đỏ) | |||
| Muối | |||||
| 3 | 2 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 3Cl2 + 2Fe → 2FeCl3
3Cl2 + 2Fe → 2FeCl3 là Phản ứng oxi-hoá khử, Cl2 (clo) phản ứng với Fe (sắt) để tạo ra FeCl3 (Sắt triclorua) dười điều kiện phản ứng là Nhiệt độ: > 250
Điều kiện phản ứng Cl2 (clo) tác dụng Fe (sắt) là gì ?
Nhiệt độ: > 250
Làm cách nào để Cl2 (clo) tác dụng Fe (sắt) xảy ra phản ứng?
cho dây sắt quấn hình lò xo (đã được nung nóng đỏ) vào lọ đựng khí clo
Hiện tượng nhận biết nếu phản ứng xảy ra 3Cl2 + 2Fe → 2FeCl3 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 3Cl2 + 2Fe → 2FeCl3
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 3Cl2 + 2Fe → 2FeCl3
Click để xem tất cả câu hỏi có liên quan tới phương trình 3Cl2 + 2Fe → 2FeCl3Câu 1. Clorua - Axit clohidric
Kim loại nào sau đây khi tác dụng với khí clo và dung dịch axit clohiđric cho ra cùng một loại muối?
A. Al
B. Ag
C. Cu
D. Fe
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiHãy chia sẽ cho bạn bè nếu nếu tài liệu này là hữu ích nhé
Chia sẻ qua facebook
Hoặc chia sẽ link trực tiếp:
http://v1.phuongtrinhhoahoc.com/chuoi-phuong-trinh-hoa-hoc/chuoi-phan-ung-ve-halogen-23Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
















