chuỗi phương trình phản ứng hóa học 8
chuỗi phương trình phản ứng hóa học 8
chuỗi phương trình phản ứng hóa học 8
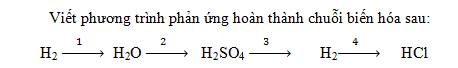
Đầu tiên cho H2 phản ứng với oxi thu được nước.
Tiếp theo, cho nước tác dụng với SO3 thu được H2SO4.
Kế tiếp, cho H2SO4 phản ứng với bari thu được muối và giải phóng hidro.
Cuối cùng, cho hidro tác dụng với clo thu được HCl.
Tóm Tắt Phương Trình Liên Quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Đánh giá
Chi Tiết Phương Trình Liên Quan
Xin lưu ý đây chỉ là phương trình chúng tôi đề nghị, bạn hoàn toàn có thể dùng các phương trình thay thể thỏa điều kiệm của chuỗi
Chi Tiết Phương Trình Số 1
Phương Trình Kết Quả Số #2
Cách viết phương trình đã cân bằng
 |  |  | |||
| 2H2 | + | O2 | → | 2H2O | |
| hidro | oxi | nước | |||
| Hydrogen | |||||
| (khí) | (khí) | (khí) | |||
| (không màu) | (không màu) | (không màu) | |||
| 2 | 1 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2H2 + O2 → 2H2O
2H2 + O2 → 2H2O là Phản ứng hoá hợpPhản ứng oxi-hoá khử, H2 (hidro) phản ứng với O2 (oxi) để tạo ra H2O (nước) dười điều kiện phản ứng là Nhiệt độ: 550°C Điều kiện khác: cháy trong không khí
Điều kiện phản ứng H2 (hidro) tác dụng O2 (oxi) là gì ?
Nhiệt độ: 550°C Điều kiện khác: cháy trong không khí
Làm cách nào để H2 (hidro) tác dụng O2 (oxi) xảy ra phản ứng?
cho H2 tác dụng với O2
Hiện tượng nhận biết nếu phản ứng xảy ra 2H2 + O2 → 2H2O là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm H2O (nước) (trạng thái: khí) (màu sắc: không màu), được sinh ra
Hoặc bạn phải quan sát chất tham gia H2 (hidro) (trạng thái: khí) (màu sắc: không màu), O2 (oxi) (trạng thái: khí) (màu sắc: không màu), biến mất.
Giải thích chi tiết về các phân loại của phương trình 2H2 + O2 → 2H2O
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 2H2 + O2 → 2H2O
Click để xem tất cả câu hỏi có liên quan tới phương trình 2H2 + O2 → 2H2OCâu 1. Phát biểu
Cho các phát biểu sau:
(1) Khí SO2 gây ra hiện tượng hiệu ứng nhà kính.
(2) Khí CO2 gây ra hiện tượng mưa axit.
(3) Các dạng nhiên liệu như than, dầu mỏ và khí tự nhiên được gọi là nhiên liệu hóa thạch.
(4) Khi được thải ra khí quyển, freon (chủ yếu là CFCl3 và CF2Cl2) phá hủy tầng ozon.
(5) Các nguồn năng lượng: thủy điện, gió, mặt trời đều là những nguồn năng lượng sạch.
Những phát biểu đúng là
A. (3), (4), (5).
B. (1), (2), (4).
C. (1), (2), (4), (5).
D. (2), (3), (4), (5).
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 2
Phương Trình Kết Quả Số #3
Cách viết phương trình đã cân bằng
 | .jpg) |  | |||
| H2O | + | SO3 | → | H2SO4 | |
| nước | sulfuarơ | axit sulfuric | |||
| Sulfur trioxit | Sulfuric acid; | ||||
| (lỏng) | (lỏng) | (dd) | |||
| (không màu) | (không màu) | (không màu) | |||
| Axit | |||||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình H2O + SO3 → H2SO4
H2O + SO3 → H2SO4 là Phương Trình Phản Ứng Hóa Học, H2O (nước) phản ứng với SO3 (sulfuarơ) để tạo ra H2SO4 (axit sulfuric) dười điều kiện phản ứng là Không có
Điều kiện phản ứng H2O (nước) tác dụng SO3 (sulfuarơ) là gì ?
Không có
Làm cách nào để H2O (nước) tác dụng SO3 (sulfuarơ) xảy ra phản ứng?
cho SO3 sục qua H2O.
Hiện tượng nhận biết nếu phản ứng xảy ra H2O + SO3 → H2SO4 là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm H2SO4 (axit sulfuric) (trạng thái: dd) (màu sắc: không màu), được sinh ra
Hoặc bạn phải quan sát chất tham gia H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), SO3 (sulfuarơ) (trạng thái: lỏng) (màu sắc: không màu), biến mất.
Giải thích chi tiết về các phân loại của phương trình H2O + SO3 → H2SO4
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 3
Phương Trình Kết Quả Số #4
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| H2SO4 | + | Ba | → | H2 | + | BaSO4 | |
| axit sulfuric | Bari | hidro | Bari sunfat | ||||
| Sulfuric acid; | Hydrogen | ||||||
| (dd) | (rắn) | (khí) | (kt) | ||||
| (không màu) | (không màu) | (trắng) | |||||
| Axit | Muối | ||||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình H2SO4 + Ba → H2 + BaSO4
H2SO4 + Ba → H2 + BaSO4 là Phương Trình Phản Ứng Hóa Học, H2SO4 (axit sulfuric) phản ứng với Ba (Bari) để tạo ra H2 (hidro), BaSO4 (Bari sunfat) dười điều kiện phản ứng là Không có
Điều kiện phản ứng H2SO4 (axit sulfuric) tác dụng Ba (Bari) là gì ?
Không có
Làm cách nào để H2SO4 (axit sulfuric) tác dụng Ba (Bari) xảy ra phản ứng?
Cho Ba tác dụng với axit H2SO4 loãng.
Hiện tượng nhận biết nếu phản ứng xảy ra H2SO4 + Ba → H2 + BaSO4 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình H2SO4 + Ba → H2 + BaSO4
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình H2SO4 + Ba → H2 + BaSO4
Click để xem tất cả câu hỏi có liên quan tới phương trình H2SO4 + Ba → H2 + BaSO4Câu 1. Nhận biết
Chỉ dùng một thuốc thử phân biệt các kim loại sau: Mg, Zn, Fe, Ba?
A. Nước.
B. Dung dịch H2SO4 loãng.
C. Dung dịch NaCl.
D. Dung dịch NaOH.
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 4
Phương Trình Kết Quả Số #5
Cách viết phương trình đã cân bằng
 |  |  | |||
| Cl2 | + | H2 | → | 2HCl | |
| clo | hidro | axit clohidric | |||
| Chlorine | Hydrogen | ||||
| (khí) | (khí) | (khí) | |||
| (vàng lục) | (không màu) | (không màu) | |||
| Axit | |||||
| 1 | 1 | 2 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Cl2 + H2 → 2HCl
Cl2 + H2 → 2HCl là Phản ứng hoá hợpPhản ứng oxi-hoá khử, Cl2 (clo) phản ứng với H2 (hidro) để tạo ra HCl (axit clohidric) dười điều kiện phản ứng là Nhiệt độ: cháy trong H2 Cl2 hoặc ở nhiệt độ phòng Điều kiện khác: có ánh sáng
Điều kiện phản ứng Cl2 (clo) tác dụng H2 (hidro) là gì ?
Nhiệt độ: cháy trong H2 Cl2 hoặc ở nhiệt độ phòng Điều kiện khác: có ánh sáng
Làm cách nào để Cl2 (clo) tác dụng H2 (hidro) xảy ra phản ứng?
đưa hidro đang cháy vào lọ đựng khí clo. Sau phản ứng, cho một ít nước vào lọ lắc nhẹ rồi dùng giấy quỳ tím để thử.
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + H2 → 2HCl là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình Cl2 + H2 → 2HCl
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Cl2 + H2 → 2HCl
Click để xem tất cả câu hỏi có liên quan tới phương trình Cl2 + H2 → 2HClCâu 1. Cân bằng hóa học
Cho các cân bằng:
1) H2 + I2(rắn) ←→ 2HI
2) N2 + 3H2 ←→ 2NH3
3) H2 + Cl2 ←→ 2HCl
4) 2SO2 (k) + O2 (k) ←→ 2SO3
5) SO2 + Cl2 ←→ SO2Cl2
Khi tăng áp suất chung của cả hệ số cân bằng chuyển dịch theo chiều thuận và
chiều nghịch lần lượt là:
A. 3 và 2
B. 3 và 1
C. 2 và 4
D. 2 và 5
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiHãy chia sẽ cho bạn bè nếu nếu tài liệu này là hữu ích nhé
Chia sẻ qua facebook
Hoặc chia sẽ link trực tiếp:
http://v1.phuongtrinhhoahoc.com/chuoi-phuong-trinh-hoa-hoc/chuoi-phuong-trinh-phan-ung-hoa-hoc-8-104Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
















