Chất Hóa Học - HCl - axit clohidric
hydrogen chloride
HCl
công thức rút gọn ClH
 axit clohidric
axit clohidric
 hydrogen chloride
hydrogen chloride
| Hình ảnh thực tế | Hình công thức cấu tạo | Hình cấu trúc không gian |
Tính chất vật lý
Nguyên tử / Phân tử khối (g/mol) 36.4609
Khối lượng riêng (kg/m3) 1180
Trạng thái thông thường Chất lỏng
Nhiệt độ sôi (°C) 110
Tính chất hóa học
Ứng dụng
Hydro clorua là một chất khí không màu đến hơi vàng, có tính ăn mòn, không cháy, nặng hơn không khí và có mùi khó chịu ở nhiệt độ và áp suất thường. Dung dịch của khí HCl trong nước được gọi là axit clohidric. Axit clohidric thường được bán trên thị trường dưới dạng dung dịch chứa 28 - 35 % thường được gọi là axit clohydric đậm đặc. Hydro clorua có nhiều công dụng, bao gồm làm sạch, tẩy, mạ điện kim loại, thuộc da, tinh chế và sản xuất nhiều loại sản phẩm. Axit clohidric có rất nhiều công dụng như sử dụng trong sản xuất clorua, phân bón và thuốc nhuộm, trong mạ điện và trong các ngành công nghiệp nhiếp ảnh, dệt may và cao su.
1. Ứng dụng của hidro clorua
Hydro clorua có thể được giải phóng từ núi lửa và nó có thể được hình thành trong quá trình đốt cháy nhiều loại nhựa. Sau đây là một số ứng dụng nổi bật của hidro clorua:
- Sản xuất axit clohidric
- Hidroclorinat hóa cao su
- Sản xuất các clorua vinyl và alkyl
- Là chất trung gian hóa học trong các sản xuất hóa chất khác
- Làm chất trợ chảy babit
- Xử lý bông
- Trong công nghiệp bán dẫn (loại tinh khiết) như khắc các tinh thể bán dẫn; chuyển silic thành SiHCl3 để làm tinh khiết sillic.
2. Ứng dụng của axit clohidric
Axit clohidric là một axit mạnh được sử dụng trong nhiều ngành công nghiệp.
a. Tẩy gỉ thép
Một trong những ứng dụng quan trọng của axit clohidric là dùng để loại bỏ gỉ trên thép, đó là các oxit sắt, trước khi thép được đưa vào sử dụng với những mục đích khác như cán, mạ điện và những kỹ thuật khác. HCl dùng trong kỹ thuật có nồng độ 18% là phổ biến, được dùng làm chất tẩy gỉ của các loại thép carbon.

Công nghiệp tẩy thép đã phát triển các công nghệ "tái chế axit clohidric" như công nghệ lò phun hoặc công nghệ tái sinh HCl tầng sôi, quá trình này cho phép thu hồi HCl từ chất lỏng đã tẩy rửa.
b. Sản xuất các hợp chất hữu cơ
Trong tổng hợp hữu cơ, axit clohidric được dùng để tổng hợp vinyl clorua và dicloroetan để sản xuất PVC. Tuy nhiên, quá trình này các doanh nghiệp sẽ sử dụng axit do họ sản xuất chứ không phải axit từ thị trường tự do.
Một số chất hữu cơ khác được sản xuất từ axit HCl đó là bisphenol A , polycacbonat, than hoạt tính, axit ascobic cũng như một số sản phẩm của ngành Dược.
c. Sản xuất các hợp chất vô cơ
Các hóa chất vô cơ được tổng hợp từ axit clohidric đó là sắt (III) clorua và polyaluminium clorua (PAC). Hai hóa chất này được sử dụng làm chất keo tục và chất đông tụ để làm lắng các thành phần trong quá trình xử lý nước thải, sản xuất nước uống và sản xuất giấy.
Ngoài ra, các hợp chất vô cơ khác được sản xuất dùng HCl như muối canxi clorua, niken (II) clorua dùng cho việc mạ điện và kẽm clorua cho công nghiệp mạ và sản xuất pin.
d. Kiểm soát và trung hòa pH
Trong công nghiệp yêu cầu độ tinh khiết (thực phẩm, dược phẩm, nước uống), axit clohidric chất lượng cao được dùng để điều chỉnh pH của nước cần xử lý. Trong ngành công nghiệp không yêu cầu độ tinh khiết cao, axit clohidric chất lượng công nghiệp chỉ cần đủ để trung hòa nước thải và xử lý nước hồ bơi.
e. Tái sinh bằng cách trao đổi ion
Axit HCl chất lượng cao được dùng để tái sinh các nhựa trao đổi ion. Trao đổi cation được sử dụng rộng rãi để loại các ion như Na+ và Ca2+ từ các dung dịch chứa nước, tạo ra nước khử khoáng.
Trao đổi ion và nước khử khoáng được sử dụng trong tất cả các ngành công nghiệp hóa, sản xuất nước uống, và một số ngành công nghiệp thực phẩm.
f. Trong sinh vật
Axit gastric là một trong những chất chính tiết ra từ dạ dày. Nó chứa chủ yếu là axit clohidric và tạo môi trường axit trong dạ dày với pH từ 1 đến 2.
Các ion Cl- và H+ được tiết ra riêng biệt trong vùng đáy vị của dạ dày bởi các tế bào vách của niêm mạc dạ dày vào hệ tiết dịch gọi là tiểu quản trước khi chúng đi vào lumen dạ dày.
Axit gastric giữ vai trò như một chất kháng lại ác vi sinh vật để ngăn ngừa nhiễm trùng và là yếu tố quan trọng để tiêu hóa thức ăn. pH dạ dày thấp làm biến tính các protein và do đó làm chúng dễ bị phân hủy bởi các enzym tiêu hóa như pepsin. Sau khi ra khỏi dạ dày, axit clohydric của dịch sữa bị natri bicacbonat vô hiệu hóa trong tá tràng.
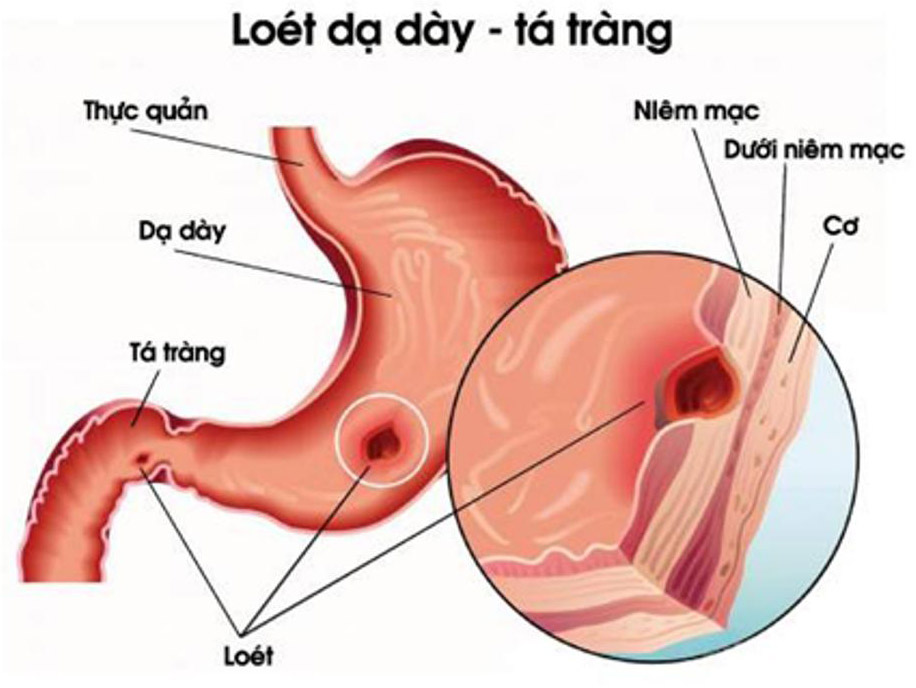
Axit gastric là một trong những chất chính tiết ra từ dạ dày. Nó chứa chủ yếu là axit clohidric và tạo môi trường axit trong dạ dày với pH từ 1 đến 2.
Dạ dày tự nó được bảo vệ khỏi axit mạnh bằng cách tiết ra một lớp chất nhầy mỏng để bảo vệ, và bằng cách tiết ra dịch tiết tố để tạo ra lớp đệm natri bicacbonat. Loét dạ dày có thể xảy ra khi các cơ chế này bị hỏng. Các thuốc nhóm kháng histamine và ức chế bơm proton (proton pump inhibitor) có thể ức chế việc tiết axit trong dạ dày, và các chất kháng axit được sử dụng để trung hòa axit có mặt trong dạ dày.
Độc tính
Hydro clorua và axit clohidric đều có tính ăn mòn mắt, da và màng nhầy. Phơi nhiễm cấp tính (ngắn hạn) qua đường hô hấp có thể gây kích ứng mắt, mũi và đường hô hấp, viêm và phù phổi ở người. Tiếp xúc cấp tính qua đường miệng có thể gây ăn mòn màng nhầy, thực quản, dạ dày, và tiếp xúc qua da có thể gây bỏng nặng, loét và để lại sẹo ở người.
Tiếp xúc nghề nghiệp lâu dài với axit clohydric sẽ gây ra viêm dạ dày, viêm phé quản mãn tính, viêm da và nhạy cảm với ánh sáng ở người lao động. Tiếc xúc lâu dài ở nồng độ thấp cũng có thể gây ra sự đổi màu và mòn răng.
Đánh giá
Hãy chia sẽ cho bạn bè nếu nếu tài liệu này là hữu ích nhé
Chia sẻ qua facebook
Hoặc chia sẽ link trực tiếp:
http://v1.phuongtrinhhoahoc.com/chat-hoa-hoc-HCl-axit+clohidric-101Các bài học trong SGK
Các bài học trong Sách Giáo Khoa bạn có thể tham khảo thêm
Bài 29. Bài luyện tập 5 – Hóa học 8
Nắm vững những tính chất và điều chế khí oxi, thành phần của không khí, định nghĩa và phân loại oxit, sự oxi hoá, phản ứng hoá hợp, phản ứng phân huỷ.
Bài 30. Bài thực hành 4
Củng cố kiến thức về nguyên tắc điều chế khí oxi trong phòng thí nghiệm, về tính chất vật lý và tính chất hoá học của oxi. Đồng thời rèn luyện kĩ năng lắp ráp dụng cụ thí nghiệm điều chế và thu khí oxi vào ống nghiệm bằng cách đây không khí và đẩy nước.
CHƯƠNG 5 HIĐRO – NƯỚC
+ Hiđro có những tính chất và ứng dụng gì ? + Phản ứng oxi hoá - khử là gì ? Thế nào là chất khử, chất oxi hoá ? - Điều chế khí hiđro trong phòng thí nghiệm và trong công nghiệp như thế nào ? - Phản ứng thế là gì ? Thành phần, tính chất của nước như thế nào ? Vai trò của nước trong đời sống và sản xuất như thế nào ? Phải làm gì để giữ cho nguồn nước không bị ô nhiễm ?
Bài 32. Phản ứng oxi hóa – khử
- Sự khử (quá trình khử) của một chất là làm cho chất đó nhận electron hay làm giảm số oxi hoá của chất đó. - Sự oxi hoá (quá trình oxi hoá) của một chất là làm cho chất đó nhường electron hay làm tăng số oxi hoá của chất đó.
Bài 33. Điều chế khí hiđro – Phản ứng thế
Như chúng ta đã biết, những ứng dụng của hidro là không thể bàn cãi. Nhưng khí hidro không có sẵn cho chúng ta sử dụng vào đời sống và sản xuất. Vậy, trong phòng thí nghiệm và trong công nghiệp, khí hidro được điều chế như thế nào? Phản ứng điều chế khí hidro thuộc loại phản ứng gì? Chúng ta sẽ cùng tìm hiểu những vấn đề này trong bài viết sau đây các bạn nhé!
Các câu hỏi có liên quan tới chất hóa học HCl (axit clohidric)
Dưới đây là các câu hỏi về liệu HCl có thể tác dụng với chất nào khác không. Bạn có thể
HCl có tác dụng với K2S không? HCl có tác dụng với K2S2O8 không? HCl có tác dụng với K3PO4 không? HCl có tác dụng với KBr không? HCl có tác dụng với KCl không? HCl có tác dụng với KClO3 không? HCl có tác dụng với KI không? HCl có tác dụng với KMnO4 không? HCl có tác dụng với KNO2 không? HCl có tác dụng với KNO3 không? HCl có tác dụng với KOH không? HCl có tác dụng với Li không? HCl có tác dụng với Mg không? HCl có tác dụng với Mg(NO3)2 không? HCl có tác dụng với Mg(OH)2 không? HCl có tác dụng với MgCO3 không? HCl có tác dụng với Mn không? HCl có tác dụng với MnO2 không? HCl có tác dụng với MnSO4 không? HCl có tác dụng với N2 không? HCl có tác dụng với N2O5 không? HCl có tác dụng với Na không? HCl có tác dụng với Na2CO3 không? HCl có tác dụng với Na2HPO4 không? HCl có tác dụng với Na2O không? HCl có tác dụng với Na2S không? HCl có tác dụng với Na2S2O3 không? HCl có tác dụng với Na2SiO3 không? HCl có tác dụng với Na2SO3 không? HCl có tác dụng với Na2SO4 không? HCl có tác dụng với Na3PO4 không? HCl có tác dụng với NaCH3COO không? HCl có tác dụng với NaCl không? HCl có tác dụng với NaClO không? HCl có tác dụng với NaHCO3 không? HCl có tác dụng với NaI không? HCl có tác dụng với NaNO2 không? HCl có tác dụng với NaNO3 không? HCl có tác dụng với NaOH không? HCl có tác dụng với NH3 không? HCl có tác dụng với NH4Cl không? HCl có tác dụng với NH4NO2 không? HCl có tác dụng với NH4NO3 không? HCl có tác dụng với NO không? HCl có tác dụng với NO2 không? HCl có tác dụng với O2 không? HCl có tác dụng với O3 không? HCl có tác dụng với P không? HCl có tác dụng với P2O5 không? HCl có tác dụng với Pb(NO3)2 không? HCl có tác dụng với Pb(OH)2 không? HCl có tác dụng với PH3 không? HCl có tác dụng với PI3 không? HCl có tác dụng với Pt không? HCl có tác dụng với S không? HCl có tác dụng với Si không? HCl có tác dụng với SiO2 không? HCl có tác dụng với Sn(OH)2 không? HCl có tác dụng với SO2 không? HCl có tác dụng với SO3 không? HCl có tác dụng với Zn không? HCl có tác dụng với Zn3P2 không? HCl có tác dụng với ZnO không? HCl có tác dụng với ZnS không? HCl có tác dụng với ZnSO4 không? HCl có tác dụng với ZnCl2 không? HCl có tác dụng với N2O4 không? HCl có tác dụng với N2O không? HCl có tác dụng với HNO2 không? HCl có tác dụng với NiO không? HCl có tác dụng với CrO3 không? HCl có tác dụng với Mn2O7 không? HCl có tác dụng với Ni(OH)3 không? HCl có tác dụng với Li2O không? HCl có tác dụng với Ba không? HCl có tác dụng với TiO2 không? HCl có tác dụng với TiCl4 không? HCl có tác dụng với Be(OH)2 không? HCl có tác dụng với Mg(HCO3)2 không? HCl có tác dụng với NH4OH không? HCl có tác dụng với NaAlO2 không? HCl có tác dụng với PbO không? HCl có tác dụng với FeSO4 không? HCl có tác dụng với MnO không? HCl có tác dụng với MgCl2 không? HCl có tác dụng với MgO không? HCl có tác dụng với BeCl2 không? HCl có tác dụng với Be không? HCl có tác dụng với BeO không? HCl có tác dụng với Be(NO3)2 không? HCl có tác dụng với H2ZnO2 không? HCl có tác dụng với HAlO2.H2O không? HCl có tác dụng với Cu2O không? HCl có tác dụng với Zn(OH)2 không? HCl có tác dụng với PdCl2 không? HCl có tác dụng với Ag2CO3 không? HCl có tác dụng với Ba(OH)2 không? HCl có tác dụng với (NH4)2S không? HCl có tác dụng với NH4HCO3 không? HCl có tác dụng với NaHSO3 không?Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Phương trình có HCl (axit clohidric) là chất tham gia
hydrogen chloride
2HCl + Zn → H2 + ZnCl2 HCl + NaOH → H2O + NaCl Fe + 2HCl → FeCl2 + H2 Xem tất cả phương trình sử dụng HClPhương trình có HCl (axit clohidric) là chất sản phẩm
hydrogen chloride
Cl2 + C3H8 → HCl + C3H7Cl CO + H2O + PdCl2 → 2HCl + CO2 + Pd C2H5Cl → C2H4 + HCl Xem tất cả phương trình tạo ra HCl
















