|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
Cl2 + 2NaOH = H2O + NaCl + NaClO | Cân Bằng Phương Trình Hóa Học
Cl2 | clo | khí + NaOH | natri hidroxit | dd = H2O | nước | lỏng + NaCl | Natri Clorua | dd + NaClO | Natri hypoclorit | dd, Điều kiện
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
- Điều kiện phản ứng để Cl2 (clo) tác dụng NaOH (natri hidroxit) là gì ?
- Làm cách nào để Cl2 (clo) tác dụng NaOH (natri hidroxit)?
- Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + 2NaOH → H2O + NaCl + NaClO là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Cl2 + 2NaOH → H2O + NaCl + NaClO ?
- Giải thích chi tiết về các phân loại của phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
- Chuỗi phương trình hóa học có sử dụng Cl2 + 2NaOH → H2O + NaCl + NaClO
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| Cl2 | + | 2NaOH | → | H2O | + | NaCl | + | NaClO | |
| clo | natri hidroxit | nước | Natri Clorua | Natri hypoclorit | |||||
| Chlorine | Sodium hydroxide | natri clorua | Sodium hypochlorite | ||||||
| (khí) | (dd) | (lỏng) | (dd) | (dd) | |||||
| (vàng lục) | (không màu) | (không màu) | (không màu) | ||||||
| Bazơ | Muối | Muối | |||||||
| 71 | 40 | 18 | 58 | 74 | |||||
| 1 | 2 | 1 | 1 | 1 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
Cl2 + 2NaOH → H2O + NaCl + NaClO là Phản ứng oxi-hoá khử, Cl2 (clo) phản ứng với NaOH (natri hidroxit) để tạo ra H2O (nước), NaCl (Natri Clorua), NaClO (Natri hypoclorit) dười điều kiện phản ứng là Không có
Điều kiện phản ứng Cl2 (clo) tác dụng NaOH (natri hidroxit) là gì ?
Không có
Làm cách nào để Cl2 (clo) tác dụng NaOH (natri hidroxit) xảy ra phản ứng?
Dẫn khí clo vào ống nghiệm đựng dung dịch NaOH. Nhỏ 1-2 giọt dung dịch vừa tạo thành mẩi giấy quỳ tím.
Nếu đang làm bài tập các bạn có thể viết đơn giản là Cl2 (clo) tác dụng NaOH (natri hidroxit) và tạo ra chất H2O (nước), NaCl (Natri Clorua), NaClO (Natri hypoclorit)
Hiện tượng nhận biết nếu phản ứng xảy ra Cl2 + 2NaOH → H2O + NaCl + NaClO là gì ?
Màu vàng lục của khí Clo (Cl2) nhạt dần trong dung dịch.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Cl2 + 2NaOH → H2O + NaCl + NaClO
Dung dịch hỗn hợp hai muối natri clorua NaCl và natri hipoclorit NaClO được gọi là nước Gia-ven. dung dịch này có tính tẩy màu vì tương tự như HClO, NaClO là chất oxi hoá mạnh.
Phương Trình Điều Chế Từ Cl2 Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Cl2 (clo) ra H2O (nước)
Xem tất cả phương trình điều chế từ Cl2 (clo) ra H2O (nước)Phương Trình Điều Chế Từ Cl2 Ra NaCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Cl2 (clo) ra NaCl (Natri Clorua)
Xem tất cả phương trình điều chế từ Cl2 (clo) ra NaCl (Natri Clorua)Phương Trình Điều Chế Từ Cl2 Ra NaClO
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Cl2 (clo) ra NaClO (Natri hypoclorit)
Xem tất cả phương trình điều chế từ Cl2 (clo) ra NaClO (Natri hypoclorit)Phương Trình Điều Chế Từ NaOH Ra H2O
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ NaOH (natri hidroxit) ra H2O (nước)
Xem tất cả phương trình điều chế từ NaOH (natri hidroxit) ra H2O (nước)Phương Trình Điều Chế Từ NaOH Ra NaCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ NaOH (natri hidroxit) ra NaCl (Natri Clorua)
Xem tất cả phương trình điều chế từ NaOH (natri hidroxit) ra NaCl (Natri Clorua)Phương Trình Điều Chế Từ NaOH Ra NaClO
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ NaOH (natri hidroxit) ra NaClO (Natri hypoclorit)
Xem tất cả phương trình điều chế từ NaOH (natri hidroxit) ra NaClO (Natri hypoclorit)Giải thích chi tiết về các phân loại của phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Cl2 + 2NaOH → H2O + NaCl + NaClO
Click để xem tất cả câu hỏi có liên quan tới phương trình Cl2 + 2NaOH → H2O + NaCl + NaClOCâu 1. Phản ứng hóa học
Cho các phản ứng sau:
MnO2 + HCl (đặc) (t0) → Khí X + ... (1);
Na2SO3 + H2SO4 (đặc) (t0)→ Khí Y + ... (2);
NH4Cl + NaOH (t0) → Khí Z + ... (3);
NaCl (r) + H2SO4 (đặc) (t0) → Khí G + ... (4);
Cu + HNO3 (đặc) (t0) → Khí E + ... (5);
FeS + HCl (t0) → Khí F + ... (6);
Những khí tác dụng được với NaOH (trong dung dịch) ở điều kiện thường là:
A. X, Y, Z, G.
B. X, Y, G.
C. X, Y, G, E, F.
D. X, Y, Z, G, E, F.
Xem đáp án câu 1
Câu 2. Phản ứng hóa học
Cho các cặp chất sau:
(1). Khí Cl2 và khí O2.
(2). Khí H2S và khí SO2.
(3). Khí H2S và dung dịch Pb(NO3)2.
(4). Khí Cl2 và dung dịch NaOH.
(5). Khí NH3 và dung dịch AlCl3.
(6). Dung dịch KMnO4 và khí SO2.
(7). Hg và S.
(8). Khí CO2 và dung dịch NaClO.
(9). CuS và dung dịch HCl.
(10). Dung dịch AgNO3 và dung dịch Fe(NO3)2.
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là
A. 8
B. 7
C. 9
D. 10
Xem đáp án câu 2
Câu 3. Phản ứng hóa học
Cho các cặp chất sau:
(1). Khí Cl2 và khí O2.
(2). Khí H2S và khí SO2.
(3). Khí H2S và dung dịch Pb(NO3)2.
(4). Khí Cl2 và dung dịch NaOH.
(5). Khí NH3 và dung dịch AlCl3.
(6). Dung dịch KMnO4 và khí SO2.
(7). Hg và S.
(8). Khí CO2 và dung dịch NaClO.
(9). CuS và dung dịch HCl.
(10). Dung dịch AgNO3 và dung dịch Fe(NO3)2.
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là
A. 8
B. 7
C. 9
D. 10
Xem đáp án câu 3
Câu 4. Thí nghiệm
Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Sục khí Cl2 dư vào dung dịch FeSO4.
(c) Cho hỗn hợp NaHSO4 và NaHCO3 (tỉ lệ mol 1 : 1) vào nước.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
(e) Sục khí NO2 vào dung dịch KOH.
Sau khi các phản ứng kết thúc, số thí nghiệm mà dung dịch thu được có hai muối là:
A. 2
B. 5
C. 3
D. 4
Xem đáp án câu 4
Câu 5. Điện phân
Tiến hành điện phân dung dịch NaCl bằng điện cực trơ, thu được một khí X duy nhất. Điều khẳng định nào sau đây là đúng ?
A. X là khí oxi
B. X là khí clo
C. X là khí hiđro
D. Có dùng màng ngăn xốp
Xem đáp án câu 5
Câu 6. Phản ứng tạo hai muối
Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Sục khí Cl2 dư vào dung dịch FeSO4.
(c) Cho hỗn hợp NaHSO4 và NaHCO3 (tỉ lệ mol 1 : 1) vào nước.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
(e) Sục khí NO2 vào dung dịch KOH.
Sau khi các phản ứng kết thúc, số thí nghiệm mà dung dịch thu được có hai muối là:
A. 2
B. 5
C. 3
D. 4
Xem đáp án câu 6
Câu 7. Chất khí sinh ra sau phản ứng tác dụng được với dd NaOH
Có các phản ứng:
1) Cu + HNO3 loãng → khí X +...
2 ) MnO2 + HCl đặc → khí Y + ...
3) NaHSO3 + NaHSO4 → khí Z + ...
4) Ba(HCO3)2 + HNO3 → khí T + ...
Các khí sinh ra tác dụng được với dung dịch NaOH là
A. X, Y, Z, T.
B. Y, Z, T.
C. Z, T.
D. Y, T.
Xem đáp án câu 7
Câu 8. Cặp chất xảy ra phản ứng ở t0 thường
Cho các cặp chất sau:
(1). Khí Cl2 và khí O2.
(2). Khí H2S và khí SO2.
(3). Khí H2S và dung dịch Pb(NO3)2.
(4). Khí Cl2 và dung dịch NaOH.
(5). Khí NH3 và dung dịch AlCl3.
(6). Dung dịch KMnO4 và khí SO2.
(7). Hg và S.
(8). Khí CO2 và dung dịch NaClO.
(9). CuS và dung dịch HCl.
(10). Dung dịch AgNO3 và dung dịch Fe(NO3)2.
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là
A. 8
B. 7
C. 9
D. 10
Xem đáp án câu 8
Câu 9. Chất làm khô clo ẩm
Chất dùng để làm khô khí Cl2 ẩm là
A. Dung dịch H2SO4 đậm đặc.
B. Na2SO3 khan.
C. CaO.
D. Dung dịch NaOH đặc.
Xem đáp án câu 9
Câu 10. Chất tác dụng với dd NaOH loãng ở t0 thường
Cho các chất: NaHCO3, CO, Al(OH)3, Fe(OH)3, HF, Cl2, NH4Cl. Số
chất tác dụng được với dung dịch NaOH loãng ở nhiệt độ thường là
A. 4
B. 5
C. 3
D. 6
Xem đáp án câu 10
Câu 11. Clorua
Cho 69,6 gam mangan đioxit tác dụng hết với dung dịch axit clohidric đặc. Toàn bộ lượng khí clo sinh ra được hấp thu hết vào 500 ml dung dịch NaOH 4M, thu được 500 ml dung dịch X. Nồng độ mol của NaCl và NaOH trong dung dịch X lần lượt là
A. 1,6M và 0,8M
B. 1,6M và 1,6M
C. 3,2M và 1,6M
D. 0,8M và 0,8M
Xem đáp án câu 11
Câu 12. Oxi hóa - khử
Cho các phương trình hóa học sau:
Cl2 + H2O → HCl + HClO (1)
Cl2 + 2NaOH → NaClO + H2O + NaCl (2)
Trong các phản ứng trên clo đóng vai trò là chất gì?
A. Là chất oxi hóa
B. Là chất khử
C. Vừa là chất oxi hóa, vừa là chất khử
D. A,B,C đều đúng
Xem đáp án câu 12
Câu 13. Câu hỏi lý thuyết về tính chất hóa học của clo
Cho clo lần lượt vào: dd NaOH, dd Ca(OH)2, H2S, NH3. Số trường hợp clo vừa thể hiện tính oxi hóa vừa thể hiện tính khử là:
A. 3
B. 1
C. 4
D. 2
Xem đáp án câu 13
Câu 14. Câu hỏi lý thuyết về ứng dụng làm khô khí của NaOH rắn
Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí
A. NH3, SO2, CO, Cl2.
B. N2, Cl2, O2, CO2, H2.
C. N2, NO2, CO2, CH4, H2
D. NH3, O2, N2, CH4, H2
Xem đáp án câu 14
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Chuỗi phương trình hóa học có sử dụng Cl2 + 2NaOH → H2O + NaCl + NaClO
Chuỗi phản ứng về halogen
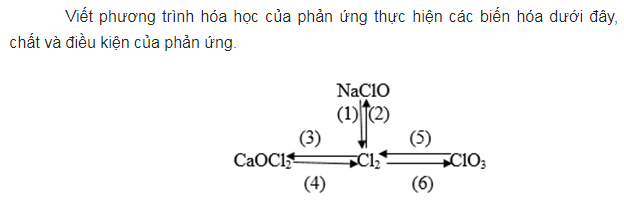
Sục khí clorua trong dung dịch NaOH sản phẩm thu được gồm muối ăn NaCl, NaClO và nước. Sau đó cho hipoclorit tác dụng với axit HCl sản phẩm tạo thành có khí thoát ra.
Cho khí clorua tác dụng với ca(OH)2 rắn sản phẩm thu được clorua vôi. Sau đó, cho clorua vôi phản ứng với với dung dịch HCl sản phẩm thu được có khí màu vàng thoát ra là clorua. Tiếp theo, chúng ta cho khí clorua phản ứng với KOH sản phẩm thu được có kali clorat. Sau đó, cho kali clorat phản ứng với dung dịch axit HCl thu được sản phẩm gồm Cl2 , KCl , H2O
Phương trình liên quan
Có 6 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về hợp chất lưu huỳnh, sắt
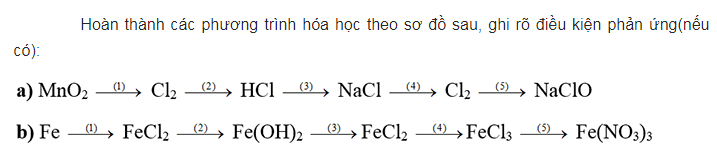
a. Cho mangan đioxit hòa tan trong dung dịch axit HCl sau phản ứng có khí màu vàng thoát ra là clo.
Sục khí clo qua dung dịch SO2 sản phẩm tạo thành gồm 2 axit HCl và H2SO4.
Tiếp theo cho kim loại natri phản ứng với axit HCl sản phẩm tạo thành là muối ăn NaCl và có khí hidro thoát ra
Hòa tan muối NaCl trong nước sản phẩm tạo thành là dung dịch bazo NaOH và có khí H2 thoát ra.
Dẫn khí clo qua dung dịch kiềm NaOH sản phẩm tạo thành 2 muối natri clorua và muối natri clorat.
b. Ngâm kim loại sắt trong dung dịch axit clohidric sản phẩm tạo thành là muối FeCl2.
Cho muối FeCl2 hòa tan trong dung dịch kiềm NaOH sản phẩm tạo thành có kết tủa trắng xanh là Fe(OH)2.
Hòa tan Fe(OH)2 trong môi trường có axit HCl sau phản ứng sản phẩm có màu lục nhạt là FeCl2.
Tiếp tục cho FeCl2 phản ứng với khí clo sau phản ứng sản phẩm chuyển thành màu vàng nâu.
Cho muối FeCl3 tác dụng với AgNO3 tạo thành muối có màu nâu là muối sắt (III) nitrat.
Phương trình liên quan
Có 10 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về halogen
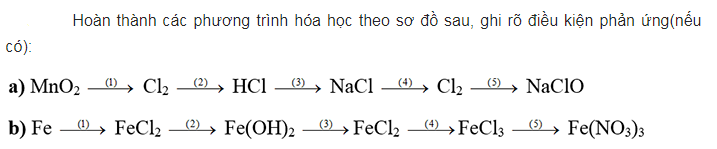
a/
Đầu tiên, cho MnO2 phản ứng với dung dịch axit HCl thu được sản phẩm gồm MnCl2, Cl2 và nước. Sau đó, cho clorua sục qua SO2 sản phẩm tạo thành là HCl. Tiếp tục cho HCl tác dụng với kim loại natri để thu được sản phẩm natri clorua, Tiếp theo, chúng ta hòa tan muối ăn NaCl trong nước sản phẩm thu được gồm khí hidro, clorua và NaOH. Cuối cùng cho clorua phản ứng với dung dịch NaOH sản phẩm tạo thành gồm muối ăn NaCl, NaClO và nước.
b/
Cho kim loại sắt phản ứng với dung dịch axit clohidric để thu được sản phẩm muối sắt II clorua, sau đó cho FeCl2 phản ứng với dung dịch bazo naOh thu được dung dịch màu trắng xanh là Fe(OH)2. Tiếp tục cho Fe(OH)2 tác dụng với axit HCl thu được muối FeCl2, sau đó ta cho FeCl2 tác dụng với khí clorua để thu được muối sắt III clorua. Cuối cùng, cho muối FeCl3 phản ứng với bạc nitrat sản phẩm thu được gồm Fe(NO3)3, AgCl
Phương trình liên quan
Có 9 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về halogen

a,
Đầu tiên, cho MnO2 phản ứng với HCl tạo thành muối MnCl2 và có khí clo thoát ra.
Tiếp theo, cho H2 phản ứng với Cl2 tạo thành HCl
Kế tiếp, cho KMnO4 phản ứng với HCl sản phẩm thu được KCl, muối MnCl2 và có khí clo thoát ra.
Cho Ca tác dụng với Cl2 tạo thành muối CaCl2
Sau đó, cho CaCl2 tác dụng NaOH tạo thành Ca(OH)2và muối NaCl
Cuối cùng, cho Cl2 tác dụng với Ca(OH)2 tạo thành CaOCl2 và H2O
b,
Đầu tiên, cho KMnO4 tác dụng với HCl tạo thành KCl và muối MnCl2 có khí clo thoát ra.
Sau đó, cho Cl2 tác dụng với K thu được muối KCl
Nhiệt phân muối KCl thu được K và có khí thoát ra Cl2
Cho clo phản ứng với H2O thu được HCl và HClO
Kế tiếp, cho Cl2 tác dụng với NaOH sản phẩm thu được gồm có NaCl và NaClO có H2O thoát ra.
Cho muối NaClO phản ứng với HCl sản phẩm tạo thành có khí Cl2 , muối NaCl và H2O
Tiếp theo, cho NaCl tác dụng với H2O kết quả thu được là khí H2 , NaOH và khí Cl2
Cuối cùng, cho Fe tác dụng với Cl2 sản phẩm tạo thành là muối FeCl3
Phương trình liên quan
Có 13 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phương trình phản ứng hóa học

Đầu tiên, điện phân nóng chảy KCl thu được kali và clo.
Tiếp theo, cho natri tác dụng với clo thu được muối natri clorua.
Sau đó, điện phân dung dịch có màng ngăn NaCl thu được thu được natri hidroxit và khí hidro và clo.
Kế tiếp, cho NaOH dung dịch phản ứng với clo thu được muối natri clorua và NaClO.
Cuối cùng, nhiệt phân NaClO thu được NaClO3 và NaCl.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Bài Viết Hóa Học Liên Quan
Bài 24. Sơ lược về hợp chất có oxi của clo
Nội dung bài giảng Sơ lược về hợp chất có oxi của clo tìm hiểu nước Javen và Clorua vôi có thành phần, tính chất, cấu tạo như thế nào? Chúng được dùng làm gì và được điều chế bằng cách nào?
Bài 30. Clo
Clo có những tính chất vật lí và hóa học đặc trưng nào? Hãy xem xét những tính chất đó theo lí thuyết đã học.
Bài 32. Hợp chất có oxi của clo
Biết công thức, cách đọc tên một số hợp chất có oxi của clo. Tính được số oxi hóa của clo trong mỗi hợp chất đó.
Bài 26. Clo
Bài giảng Clo đi sâu tìm hiểu về Tính chất vật lí của clo; Clo có một số tính chất chung của phi kim(tác dụng với kim loại, với hiđro), clo còn tác dụng với nước và dung dịch bazơ, clo là phi kim hoạtđộng mạnh; Phương pháp điều chế clo trong công nghiệp, trong phòng thí nghiệm; Một số ứng dụng, thu khí clo trong công nghiệp, trong phòng thí nghiệm.
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Bài học liên quan
Các bài học trong sách giáo khoa có sử dụng phương trình hóa học này:
Bài 24. Sơ lược về hợp chất có oxi của clo" Bài 30. Clo" Bài 32. Hợp chất có oxi của clo" Bài 26. Clo"Phương trình sản xuất ra Cl2 (clo)
(chlorine)
2H2O + 2NaCl → Cl2 + H2 + 2NaOH 4HCl + MnO2 → Cl2 + 2H2O + MnCl2 CuCl2 → Cl2 + Cu Tổng hợp tất cả phương trình điều chế ra Cl2Phương trình sản xuất ra NaOH (natri hidroxit)
(sodium hydroxide)
2H2O + 2Na → H2 + 2NaOH 2H2O + 2NaCl → Cl2 + H2 + 2NaOH Ca(OH)2 + NaHCO3 → CaCO3 + H2O + NaOH Tổng hợp tất cả phương trình điều chế ra NaOHPhương trình sử dụng H2O (nước) là chất sản phẩm
(water)
3H2O + P2O5 → 2H3PO4 Br2 + H2O + (NH4)2SO3 → (NH4)2SO4 + 2HBr Fe2(CO3)3 + 3H2O → 3CO2 + 2Fe(OH)3 Tổng hợp tất cả phương trình có H2O tham gia phản ứngPhương trình sử dụng NaCl (Natri Clorua) là chất sản phẩm
(sodium chloride)
2H2O + 2NaCl → Cl2 + H2 + 2NaOH AgNO3 + NaCl → AgCl + NaNO3 2NaCl → Cl2 + 2Na Tổng hợp tất cả phương trình có NaCl tham gia phản ứngPhương trình sử dụng NaClO (Natri hypoclorit) là chất sản phẩm
()
3NaClO + 10NaOH + 2CrCl3 → 5H2O + 9NaCl + 2Na2CrO4 2NaClO → 2NaCl + O2 H2SO4 + 2KI + 8NaClO → H2O + I2 + 8NaCl + K2SO4 Tổng hợp tất cả phương trình có NaClO tham gia phản ứng















