|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
FeS + 2HCl = FeCl2 + H2S | Cân Bằng Phương Trình Hóa Học
FeS | sắt (II) sulfua | rắn + HCl | axit clohidric | dd = FeCl2 | sắt (II) clorua | dung dịch + H2S | hidro sulfua | khí, Điều kiện
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình FeS + 2HCl → FeCl2 + H2S
- Điều kiện phản ứng để FeS (sắt (II) sulfua) tác dụng HCl (axit clohidric) là gì ?
- Làm cách nào để FeS (sắt (II) sulfua) tác dụng HCl (axit clohidric)?
- Hiện tượng nhận biết nếu phản ứng xảy ra FeS + 2HCl → FeCl2 + H2S là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng FeS + 2HCl → FeCl2 + H2S ?
- Giải thích chi tiết về các phân loại của phương trình FeS + 2HCl → FeCl2 + H2S
- Chuỗi phương trình hóa học có sử dụng FeS + 2HCl → FeCl2 + H2S
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| FeS | + | 2HCl | → | FeCl2 | + | H2S | |
| sắt (II) sulfua | axit clohidric | sắt (II) clorua | hidro sulfua | ||||
| Iron(II) sulfide | Hydro sulfid, hydro sulfua, sunfan | ||||||
| (rắn) | (dd) | (dung dịch) | (khí) | ||||
| (đen) | (không màu) | (lục nhạt) | (không màu) | ||||
| Muối | Axit | Muối | Axit | ||||
| 88 | 36 | 127 | 34 | ||||
| 1 | 2 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình FeS + 2HCl → FeCl2 + H2S
FeS + 2HCl → FeCl2 + H2S là Phản ứng trao đổi, FeS (sắt (II) sulfua) phản ứng với HCl (axit clohidric) để tạo ra FeCl2 (sắt (II) clorua), H2S (hidro sulfua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng FeS (sắt (II) sulfua) tác dụng HCl (axit clohidric) là gì ?
Không có
Làm cách nào để FeS (sắt (II) sulfua) tác dụng HCl (axit clohidric) xảy ra phản ứng?
FeS tác dụng HCl.
Nếu đang làm bài tập các bạn có thể viết đơn giản là FeS (sắt (II) sulfua) tác dụng HCl (axit clohidric) và tạo ra chất FeCl2 (sắt (II) clorua), H2S (hidro sulfua)
Hiện tượng nhận biết nếu phản ứng xảy ra FeS + 2HCl → FeCl2 + H2S là gì ?
Chất rắn màu đen của Sắt II sunfua (FeS) tan dần và dung dịch chuyển sang màu lục nhạt của Sắt II Clorua (FeCl2)
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng FeS + 2HCl → FeCl2 + H2S
Trong công nghiệp người ta không sản xuất khi hiđro sunfua. Trong phòng thí nghiệm, người ta điều chế bằng phản ứng hoá học của dung dịch axit clohiđric với sắt (II) sunfua.
Phương Trình Điều Chế Từ FeS Ra FeCl2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ FeS (sắt (II) sulfua) ra FeCl2 (sắt (II) clorua)
Xem tất cả phương trình điều chế từ FeS (sắt (II) sulfua) ra FeCl2 (sắt (II) clorua)Phương Trình Điều Chế Từ FeS Ra H2S
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ FeS (sắt (II) sulfua) ra H2S (hidro sulfua)
Xem tất cả phương trình điều chế từ FeS (sắt (II) sulfua) ra H2S (hidro sulfua)Phương Trình Điều Chế Từ HCl Ra FeCl2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HCl (axit clohidric) ra FeCl2 (sắt (II) clorua)
Xem tất cả phương trình điều chế từ HCl (axit clohidric) ra FeCl2 (sắt (II) clorua)Phương Trình Điều Chế Từ HCl Ra H2S
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HCl (axit clohidric) ra H2S (hidro sulfua)
Xem tất cả phương trình điều chế từ HCl (axit clohidric) ra H2S (hidro sulfua)Giải thích chi tiết về các phân loại của phương trình FeS + 2HCl → FeCl2 + H2S
Phản ứng trao đổi là gì ?
Phản ứng hoá học trong đó các chất trao đổi cho nhau thành phần cấu tạo của nó. Từ sự trao đổi này, chúng hình thành nên những chất mới. Trong phản ứng trao đổi, số oxi hóa của các nguyên tố không thay đổi. Các phản ứng trao đổi không phải là phản ứng oxi hóa - khử.
Xem tất cả phương trình Phản ứng trao đổi
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình FeS + 2HCl → FeCl2 + H2S
Click để xem tất cả câu hỏi có liên quan tới phương trình FeS + 2HCl → FeCl2 + H2SCâu 1. Phản ứng hóa học
Cho các phản ứng sau:
MnO2 + HCl (đặc) (t0) → Khí X + ... (1);
Na2SO3 + H2SO4 (đặc) (t0)→ Khí Y + ... (2);
NH4Cl + NaOH (t0) → Khí Z + ... (3);
NaCl (r) + H2SO4 (đặc) (t0) → Khí G + ... (4);
Cu + HNO3 (đặc) (t0) → Khí E + ... (5);
FeS + HCl (t0) → Khí F + ... (6);
Những khí tác dụng được với NaOH (trong dung dịch) ở điều kiện thường là:
A. X, Y, Z, G.
B. X, Y, G.
C. X, Y, G, E, F.
D. X, Y, Z, G, E, F.
Xem đáp án câu 1
Câu 2. Nhóm oxi lưu huỳnh
Cho các phát biểu sau:
(1). Cho các chất sau: CuO (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), PbS
(6), MgCO3 (7), AgNO3 (8), MnO2 (9), FeS (10). Axit HCl không tác dụng
được với 3 chất.
(2). Axit clohiđric vừa có tính khử vừa có tính oxi hóa .
(3). Dung dịch axit clohiđric có tính axit mạnh.
(4). Cu hòa tan trong dung dịch axit clohiđric khi có mặt O2.
(5). Fe hòa tan trong dung dịch axit clohiđric tạo muối FeCl3.
Số phát biểu sai là:
A. 4
B. 3
C. 2
D. 1
Xem đáp án câu 2
Câu 3. Phương trình ion rút gọn
Cho các phản ứng sau:
(a) FeS + 2HCl → FeCl2 + H2S
(b) Na2S + 2HCl → 2NaCl + H2S
(c) 2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
(d) KHSO4 + KHS → K2SO4 + H2S
(e) BaS + H2SO4 (loãng) → BaSO4 + H2S
Số phản ứng có phương trình ion rút gọn S2- + 2H+ → H2S là
A. 4
B. 3
C. 2
D. 1
Xem đáp án câu 3
Câu 4. Ion
Cho phản ứng sau: FeS + HCl → FeCl2 + H2S.
Phương trình ion rút gọn của phản ứng trên là:
A. H+ + S2- → H2S↑
B. Fe2+ + 2Cl- → FeCl
C. FeS(r) + 2H+ → Fe2+ + H2S↑
D. Cả 3 đúng
Xem đáp án câu 4
Câu 5. Tìm tỉ lệ
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra haonf toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng
A. 2:1
B. 1:1
C. 3:1
D. 3:2
Xem đáp án câu 5
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Chuỗi phương trình hóa học có sử dụng FeS + 2HCl → FeCl2 + H2S
Chuỗi phản ứng về oxi lưu huỳnh

Nhiệt phân muối kali clorat ở nhiệt độ 500 độ C, sản phẩm thu được là muối kali clorua.
Sự tạo thành: một phân tử oxy bị tách (quang ly) bởi tia UV tần số cao thành hai nguyên tử oxy
O2 + ℎν → 2 O•
Mỗi nguyên tử oxy sau đó nhanh chóng kết hợp lại với một phân tử oxy để tạo thành một phân tử ôzôn:
O• + O2 → O3
Cho Ag phản ứng với O3 thu được Ag2O có màu đen nâu và khí oxi thoát ra.
Oxi hóa hóa kẽm trong không khí sau phản ứng thu được ZnO màu trắng.
Cho ZnO phản ứng với axit H2SO4 sản phẩm tạo thành là muối kẽm sunfat.
Tiếp theo, cho FeS tác dụng với dung dịch axit HCl sản phẩm sau phản ứng có màu lục nhạt là muối FeCl2 và khí H2S mùi trứng thối thoát ra.
Tiếp tục cho H2S đốt cháy trong điều kiện thiếu oxi sau phản ứng ta thu được lưu huỳnh.
Sau đó lấy lưu huỳnh đốt cháy trong không khí ta thu được khí lưu huỳnh đioxit mùi hắc.
Cho SO2 tác dụng với CaO thu được muối CaSO3.
Cho CaSO3 tác dụng với axit sunfuric sản phẩm tạo thành có khí mùi sốc thoát ra là SO2.
Phương trình liên quan
Có 10 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về oxi lưu huỳnh
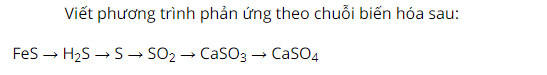
Cho FeS phản ứng với dung dịch axit HCl sau phản ứng thu được sản phẩm màu trắng xám là FeCl2 và khí mùi trứng thối thoát ra là H2S.
Đốt khí H2S trong điều kiện thiếu khí oxi có chất xúc tác V2O5 sau phản ứng có hiện tượng kết tủa vàng.
Cho khí SO2 tác dụng với CaO sản phẩm thu được là CaSO3.
Cho CaSO3 hòa tan trong dung dịch axit H2SO4 sau phản ứng có khí SO2 thoát ra.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phản ứng về oxi lưu huỳnh

Cho FeS phản ứng với axit HCl. Chất rắn màu đen của Sắt II sunfua (FeS) tan dần và dung dịch chuyển sang màu lục nhạt của Sắt II Clorua (FeCl2)
Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa đen xuất hiện
Cho H2S tác dụng với SO2 tạo thành chất bột màu vàng và có hơi nước bám ở thành ống nghiệm.
Tiếp tục cho muối sắt clorua phản ứng với clo tạo ra muối sắt (III) clorua
Cuối cùng cho muối sắt (III) clorua tác dụng với KI sản phẩm tạo thành 2 muối sắt (II) clorua và muối kali clorua và xuất hiện chất rắn màu tím than.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi các phương trình phản ứng của sắt, hợp chất sắt và axeton
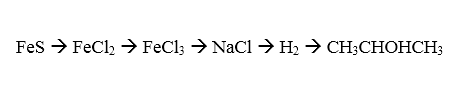
Cho sắt (II) sun fua hòa tan trong dung dịch axit HCl thu được muối FeCl2.
Cho muối sắt (II) clorua phản ứng với khí clo thu được muối sắt (III) clorua.
Hòa tan muối sắt (III) clorua troong dung dịch natri hidroxit thu được muối natri clorua.
Tiếp tục đem muối natri clorua điện phân nóng chảy có màng ngăn (với nước) giải phóng khí hidro.
Cho khí hidro phản ứng với axeton có chất xúc tác niken thu được 2-propanol.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Chuỗi phương trình phản ứng hóa học

(1) Nhiệt phân sắt pyrit ở nhiệt độ 600 độ C thu được muối FeS và lưu huỳnh kết tủa vàng.
(2) Cho FeS tác dụng với HCl thu được FeCl2 và có khí mùi trứng thối bay ra.
(3) Cho H2S tác dụng với iot thu được kết tủa vàng.
(4) Cho HI tác dụng với clo thu được kết tủa màu tím than.
(5) Cho HCl tác dụng với NaOH thu được muối natri clorua và hơi nước.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Bài Viết Hóa Học Liên Quan
Bài 32. Hiđro sunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit
Nội dung bài học Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit tìm hiểu Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit có những tính chất nào giống và khác nhau? Vì sao? Những phản ứng hóa học có thể chứng minh cho những tính chất này
Bài 44. Hidro Sunfua
Hidro Sunfua có những tính chất hóa học đặc trưng nào? Những phản ứng hóa học nào có thể minh chứng cho những tính chất này?
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Bài học liên quan
Các bài học trong sách giáo khoa có sử dụng phương trình hóa học này:
Bài 32. Hiđro sunfua – Lưu huỳnh đioxit – Lưu huỳnh trioxit" Bài 44. Hidro Sunfua"Phương trình sản xuất ra FeS (sắt (II) sulfua)
()
Fe + S → FeS Fe(NO3)2 + Na2S → FeS + 2NaNO3 Fe2(SO4)3 + 3Na2S → 2FeS + 3Na2SO4 + 2S Tổng hợp tất cả phương trình điều chế ra FeSPhương trình sản xuất ra HCl (axit clohidric)
(hydrogen chloride)
Cl2 + C3H8 → HCl + C3H7Cl CO + H2O + PdCl2 → 2HCl + CO2 + Pd Cl2 + H2S → 2HCl + S Tổng hợp tất cả phương trình điều chế ra HClPhương trình sử dụng FeCl2 (sắt (II) clorua) là chất sản phẩm
(iron(ii) chloride)
FeCl2 → Cl2 + Fe FeCl2 + 4HNO3 → H2O + 2HCl + NO2 + Fe(NO3)3 3FeCl2 + 4HNO3 → 2H2O + NO + Fe(NO3)3 + 2FeCl3 Tổng hợp tất cả phương trình có FeCl2 tham gia phản ứngPhương trình sử dụng H2S (hidro sulfua) là chất sản phẩm
(hydrogen sulfide)
2H2S + 3O2 → 2H2O + 2SO2 Cl2 + H2S → 2HCl + S 2H2S + 2NO → 2H2O + N2 + 2S Tổng hợp tất cả phương trình có H2S tham gia phản ứng















