|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
Fe + H2SO4 = H2 + FeSO4 | Cân Bằng Phương Trình Hóa Học
Fe | sắt | rắn + H2SO4 | axit sulfuric | dung dịch pha loãng = H2 | hidro | khí + FeSO4 | Sắt(II) sunfat | dd, Điều kiện Điều kiện khác trong môi trường CO2
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình Fe + H2SO4 → H2 + FeSO4
- Điều kiện phản ứng để Fe (sắt) tác dụng H2SO4 (axit sulfuric) là gì ?
- Làm cách nào để Fe (sắt) tác dụng H2SO4 (axit sulfuric)?
- Hiện tượng nhận biết nếu phản ứng xảy ra Fe + H2SO4 → H2 + FeSO4 là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Fe + H2SO4 → H2 + FeSO4 ?
- Giải thích chi tiết về các phân loại của phương trình Fe + H2SO4 → H2 + FeSO4
- Chuỗi phương trình hóa học có sử dụng Fe + H2SO4 → H2 + FeSO4
Cách viết phương trình đã cân bằng
 |  |  | 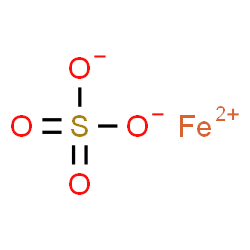 | ||||
| Fe | + | H2SO4 | → | H2 | + | FeSO4 | |
| sắt | axit sulfuric | hidro | Sắt(II) sunfat | ||||
| Iron | Sulfuric acid; | Hydrogen | Iron (II) sulfate | ||||
| (rắn) | (dung dịch pha loãng) | (khí) | (dd) | ||||
| (trắng xám) | (không màu) | (không màu) | (lục nhạt) | ||||
| Axit | Muối | ||||||
| 56 | 98 | 2 | 152 | ||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình Fe + H2SO4 → H2 + FeSO4
Fe + H2SO4 → H2 + FeSO4 là Phản ứng oxi-hoá khửPhản ứng thế, Fe (sắt) phản ứng với H2SO4 (axit sulfuric) để tạo ra H2 (hidro), FeSO4 (Sắt(II) sunfat) dười điều kiện phản ứng là Điều kiện khác: trong môi trường CO2
Điều kiện phản ứng Fe (sắt) tác dụng H2SO4 (axit sulfuric) là gì ?
Điều kiện khác: trong môi trường CO2
Làm cách nào để Fe (sắt) tác dụng H2SO4 (axit sulfuric) xảy ra phản ứng?
cho sắt tác dụng với dung dịch axit H2SO4.
Nếu đang làm bài tập các bạn có thể viết đơn giản là Fe (sắt) tác dụng H2SO4 (axit sulfuric) và tạo ra chất H2 (hidro), FeSO4 (Sắt(II) sunfat)
Hiện tượng nhận biết nếu phản ứng xảy ra Fe + H2SO4 → H2 + FeSO4 là gì ?
Sắt (Fe) tan dần trong dung dịch và sinh ra khí Hidro (H2) làm sủi bọt khí.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Fe + H2SO4 → H2 + FeSO4
Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này. Bạn có thể kéo xuống dưới bạn click vào nút báo lỗi / đóng góp để đưa thêm thông tin
Phương Trình Điều Chế Từ Fe Ra H2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe (sắt) ra H2 (hidro)
Xem tất cả phương trình điều chế từ Fe (sắt) ra H2 (hidro)Phương Trình Điều Chế Từ Fe Ra FeSO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Fe (sắt) ra FeSO4 (Sắt(II) sunfat)
Xem tất cả phương trình điều chế từ Fe (sắt) ra FeSO4 (Sắt(II) sunfat)Phương Trình Điều Chế Từ H2SO4 Ra H2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ H2SO4 (axit sulfuric) ra H2 (hidro)
Xem tất cả phương trình điều chế từ H2SO4 (axit sulfuric) ra H2 (hidro)Phương Trình Điều Chế Từ H2SO4 Ra FeSO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ H2SO4 (axit sulfuric) ra FeSO4 (Sắt(II) sunfat)
Xem tất cả phương trình điều chế từ H2SO4 (axit sulfuric) ra FeSO4 (Sắt(II) sunfat)Giải thích chi tiết về các phân loại của phương trình Fe + H2SO4 → H2 + FeSO4
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Phản ứng thế là gì ?
Phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử hợp chất hữu cơ bị thay thê bởi một nguyên tử hoặc nhóm nguyên tử khác. Phản ứng thế cũng là một loại phương trình hoá học cực kỳ phổ biến trong chương trình trung học cơ sở và trung học phổ thông.
Xem tất cả phương trình Phản ứng thế
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Fe + H2SO4 → H2 + FeSO4
Click để xem tất cả câu hỏi có liên quan tới phương trình Fe + H2SO4 → H2 + FeSO4Câu 1. Bài toán khối lượng
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Fe vào dung dịch H2SO4 loãng, dư thu dược 10,08 lít khí (đkc). Biết Fe chiếm 60,87% về khối lượng. Giá trị m là
A. 13,8 gam
B. 9,6 gam
C. 6,9 gam
D. 18,3 gam
Xem đáp án câu 1
Câu 2. Phản ứng hóa học
Tiến hành các thí nghiệm sau :
(a) Ag vào HNO3 loãng.
(b) Cr vào HCl loãng, nóng.
(c) Fe vào H2SO4 loãng nguội.
(d) Sục khí H2S vào dung dịch FeCl2.
(e) Cho Na2O vào dung dịch K2SO4.
(f) Cho Al2O3 vào dung dịch KHSO4.
Trong các thí nghiệm trên, số trường hợp xảy ra phản ứng là
A. 2
B. 4
C. 3
D. 5
Xem đáp án câu 2
Câu 3. Thí nghiệm xảy ra phản ứng hóa học
Có các thí nghiệm sau:
(1) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(2) Sục khí SO2 vào nước brom.
(3) Sục khí CO2 vào nước Javen.
(4) Nhúng lá nhôm vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hóa học là:
A. 4
B. 3
C. 2
D. 1
Xem đáp án câu 3
Câu 4. Phản ứng hóa học
Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(II) Sục khí SO2 vào nước brom.
(III) Sục khí CO2 vào nước Javen.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hóa học là:
A. 4
B. 3
C. 1
D. 2
Xem đáp án câu 4
Câu 5. Kim loại tác dung với H2SO4
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Xem đáp án câu 5
Câu 6. Tìm m
Hòa tan 8,4 gam Fe vào 500 ml dung dịch X gồm HCl 0,2M và H2SO4 0,1M. Cô cạn dung dịch thu được sau phản ứng thì thu được bao nhiêu gam muối khan?
A. 18,75 gam.
B. 16,75 gam.
C. 13,95 gam.
D. 19,55 gam.
Xem đáp án câu 6
Câu 7. Câu hỏi lý thuyết về phản ứng của kim loại với axit H2SO4
Các kim loại chỉ tác dụng với dung dịch H2SO4 loãng mà không tác dụng với dung dịch H2SO4 đặc nguội là
A. Cu và Fe
B. Fe và Al
C. Mg và Al
D. Mg và Cu
Xem đáp án câu 7
Câu 8. Bài toán kim loại tác dụng với axit H2SO4 loãng
Hòa tan hoàn toàn Fe vào dung dịch H2SO4 loãng vừa đủ thu được 4,48 lít H2 (đktc). Cô cạn dung dịch trong điều kiện không có oxi thu được m gam muối khan. Giá trị của m là
A. 30,4
B. 15,2
C. 22,8
D. 20,3
Xem đáp án câu 8
Câu 9. Bài tập xác định khí tạo thành từ phản ứng
Cho Fe tác dụng với dung dịch H2SO4 loãng tạo thành khí X; nhiệt phân tinh thể KNO3 tạo thành khí Y; cho tinh thể KMnO4 tác dụng với dung dịch HCl đặc tạo thành khí Z. Các khí X, Y và Z lần lượt là
A. SO2, O2 và Cl2
B. Cl2, O2 và H2S.
C. H2, O2 và Cl2.
D. H2, NO2 và Cl2
Xem đáp án câu 9
Câu 10. Câu hỏi lý thuyết về phản ứng giữa kim loại và axit H2SO4 loãng
Dung dịch H2SO4 loãng phản ứng được với kim loại nào sau đây?
A. Ag.
B. Cu.
C. Fe.
D. Au
Xem đáp án câu 10
Câu 11. Bài toán hỗn hợp kim loại tác dụng với dung dịch H2SO4 loãng
Cho 5,2 gam hỗn hợp gồm Al, Mg và Zn tác dụng vừa đủ với dung dịch H2SO4 10% thu được dung dịch Y và 3,36 lít khí H2 (đkc). Khối lượng của dung dịch Y là:
A. 152 gam
B. 146,7 gam
C. 175,2 gam
D. 151,9 gam
Xem đáp án câu 11
Câu 12. Bài tập về tính chất hóa học của H2SO4 loãng
Trong điều kiện thích hợp, xảy ra các phản ứng sau: (a) 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (b) 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O (c) Fe(OH)2 + H2SO4 → FeSO4 + 2H2O (d) 2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O Trong các phản ứng trên, phản ứng xảy ra với dung dịch H2SO4 loãng là
A. (d)
B. (c)
C. (a)
D. (b)
Xem đáp án câu 12
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Bài Viết Hóa Học Liên Quan
Bài 33. Điều chế khí hiđro – Phản ứng thế
Như chúng ta đã biết, những ứng dụng của hidro là không thể bàn cãi. Nhưng khí hidro không có sẵn cho chúng ta sử dụng vào đời sống và sản xuất. Vậy, trong phòng thí nghiệm và trong công nghiệp, khí hidro được điều chế như thế nào? Phản ứng điều chế khí hidro thuộc loại phản ứng gì? Chúng ta sẽ cùng tìm hiểu những vấn đề này trong bài viết sau đây các bạn nhé!
CHƯƠNG 7 SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
Nội dung bài học trình bày cụ thể, tỉ mỉ về nguyên tố rất phố biến trong đời sống và sản xuất chính là Sắt. Thông qua bài học các em học sinh biết được vị trí của Sắt trong Bảng hệ thống tuần hoàn các nguyên tố hóa học; cấu tạo nguyên tử, tính chất vật lí - hóa học và phương pháp điều chế. Biết được tính chất và ứng dụng của một số hợp chất quan trọng của Sắt.
Bài 5. Luyện tập: Tính chất hóa học của oxit và axit
Oxit bazơ, oxit axit và axit Có những tính chất hoá học nào ? Giữa chúng Có mối quan hệ về tính chất hoá học ra sao ? Vậy giữa oxit và axit liên hệ với nhau như thế nào chúng ta cùng nhau hệ thống lại qua bài hoc sau
Bài 40. Sắt
Hiểu được tính chất hóa học cơ bản của sắt và dẫn ra được những phản ứng hóa học thích hợp
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Bài học liên quan
Các bài học trong sách giáo khoa có sử dụng phương trình hóa học này:
Bài 33. Điều chế khí hiđro – Phản ứng thế" CHƯƠNG 7 SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG" Bài 5. Luyện tập: Tính chất hóa học của oxit và axit" Bài 40. Sắt"Phương trình sản xuất ra Fe (sắt)
(iron)
Fe2(SO4)3 + 3H2O → 2Fe + 3H2SO4 + 3/2O2 4CO + Fe3O4 → 3Fe + 4CO2 2Al + Fe2O3 → Al2O3 + 2Fe Tổng hợp tất cả phương trình điều chế ra FePhương trình sản xuất ra H2SO4 (axit sulfuric)
(sulfuric acid)
24HNO3 + FeCuS2 → Cu(NO3)2 + 10H2O + 2H2SO4 + 18NO2 + Fe(NO3)3 2H2O + 2KMnO4 + 5SO2 → 2H2SO4 + 2MnSO4 + K2SO4 2H2O + 2ZnSO4 → 2H2SO4 + O2 + 2Zn Tổng hợp tất cả phương trình điều chế ra H2SO4Phương trình sử dụng H2 (hidro) là chất sản phẩm
(hydrogen)
H2 + S → H2S H2 + I2 → 2HI C + 2H2 → CH4 Tổng hợp tất cả phương trình có H2 tham gia phản ứngPhương trình sử dụng FeSO4 (Sắt(II) sunfat) là chất sản phẩm
()
8H2SO4 + 2KMnO4 + 10FeSO4 → 5Fe2(SO4)3 + 8H2O + 2MnSO4 + 1K2SO4 4HNO3 + 3FeSO4 → Fe2(SO4)3 + 2H2O + NO + Fe(NO3)3 2Al + 3FeSO4 → Al2(SO4)3 + 3Fe Tổng hợp tất cả phương trình có FeSO4 tham gia phản ứng















