|
Tìm kiếm phương trình hóa học
|
| Nhóm Học Miễn Phí Online Facebook | ||||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: H2 O2 | ||||
Br2 + 2HI = I2 + 2HBr | Cân Bằng Phương Trình Hóa Học
Br2 | brom | lỏng + HI | axit iodic | dd = I2 | Iot | rắn + HBr | Hidro bromua | khí, Điều kiện
Mục Lục
- Cách viết phương trình đã cân bằng
- Thông tin chi tiết về phương trình Br2 + 2HI → I2 + 2HBr
- Điều kiện phản ứng để Br2 (brom) tác dụng HI (axit iodic) là gì ?
- Làm cách nào để Br2 (brom) tác dụng HI (axit iodic)?
- Hiện tượng nhận biết nếu phản ứng xảy ra Br2 + 2HI → I2 + 2HBr là gì ?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Br2 + 2HI → I2 + 2HBr ?
- Giải thích chi tiết về các phân loại của phương trình Br2 + 2HI → I2 + 2HBr
- Chuỗi phương trình hóa học có sử dụng Br2 + 2HI → I2 + 2HBr
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| Br2 | + | 2HI | → | I2 | + | 2HBr | |
| brom | axit iodic | Iot | Hidro bromua | ||||
| Bromine | Hydrogen iodide | Axit bromhydric | |||||
| (lỏng) | (dd) | (rắn) | (khí) | ||||
| (nâu đỏ) | (đen tím) | (không màu) | |||||
| Axit | Axit | ||||||
| 160 | 128 | 254 | 81 | ||||
| 1 | 2 | 1 | 2 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Xin hãy kéo xuống dưới để xem và thực hành các câu hỏi trắc nghiệm liên quan
☟☟☟
Thông tin chi tiết về phương trình Br2 + 2HI → I2 + 2HBr
Br2 + 2HI → I2 + 2HBr là Phản ứng oxi-hoá khử, Br2 (brom) phản ứng với HI (axit iodic) để tạo ra I2 (Iot), HBr (Hidro bromua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng Br2 (brom) tác dụng HI (axit iodic) là gì ?
Không có
Làm cách nào để Br2 (brom) tác dụng HI (axit iodic) xảy ra phản ứng?
cho brom tác dụng với HI
Nếu đang làm bài tập các bạn có thể viết đơn giản là Br2 (brom) tác dụng HI (axit iodic) và tạo ra chất I2 (Iot), HBr (Hidro bromua)
Hiện tượng nhận biết nếu phản ứng xảy ra Br2 + 2HI → I2 + 2HBr là gì ?
Dung dịch Brom (Br2) bị mất màu da cam và xuất hiện khí tím Iot (I2) .
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng Br2 + 2HI → I2 + 2HBr
Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này. Bạn có thể kéo xuống dưới bạn click vào nút báo lỗi / đóng góp để đưa thêm thông tin
Phương Trình Điều Chế Từ Br2 Ra I2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Br2 (brom) ra I2 (Iot)
Xem tất cả phương trình điều chế từ Br2 (brom) ra I2 (Iot)Phương Trình Điều Chế Từ Br2 Ra HBr
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Br2 (brom) ra HBr (Hidro bromua)
Xem tất cả phương trình điều chế từ Br2 (brom) ra HBr (Hidro bromua)Phương Trình Điều Chế Từ HI Ra I2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HI (axit iodic) ra I2 (Iot)
Xem tất cả phương trình điều chế từ HI (axit iodic) ra I2 (Iot)Phương Trình Điều Chế Từ HI Ra HBr
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ HI (axit iodic) ra HBr (Hidro bromua)
Xem tất cả phương trình điều chế từ HI (axit iodic) ra HBr (Hidro bromua)Giải thích chi tiết về các phân loại của phương trình Br2 + 2HI → I2 + 2HBr
Phản ứng oxi-hoá khử là gì ?
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học. Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểu Chất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiĐánh giá
Chuỗi phương trình hóa học có sử dụng Br2 + 2HI → I2 + 2HBr
Chuỗi phản ứng halogen của iot và brom
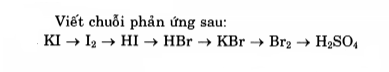
Cho KI tác dụng với clo tạo thành có hiện tượng kết tủa tím là iot.
Tiếp tục đốt cháy iot với khí hidro tạo thành HI.
Dẫn HI qua nước brom tạo thành HBr.
Tiếp tục cho HBr hòa tan trong dung dịch KOH tạo thành KBr.
Sau đó điện phân dung dịch KBr có màng ngăn thu được khí brom.
Cuối cùng, sục nước brom qua khí SO2 tạo thành axit sunfuric.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click "xem chi tiết" để thấy toàn bộ
Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
Phương trình sản xuất ra Br2 (brom)
(bromine)
8H2SO4 + 2KMnO4 + 10NaBr → 5Br2 + 8H2O + 2MnSO4 + 5Na2SO4 + K2SO4 2AgBr → 2Ag + Br2 Cl2 + 2NaBr → Br2 + 2NaCl Tổng hợp tất cả phương trình điều chế ra Br2Phương trình sản xuất ra HI (axit iodic)
(hydroiodic acid)
2H2O + CaI2 → Ca(OH)2 + 2HI H2 + I2 → 2HI H2S + I2 → 2HI + S Tổng hợp tất cả phương trình điều chế ra HIPhương trình sử dụng I2 (Iot) là chất sản phẩm
(iodine)
H2 + I2 → 2HI 2Al + 3I2 → 2AlI3 C2H5OH + I2 + NaOH → H2O + NaI + HCOONa + CHI3 Tổng hợp tất cả phương trình có I2 tham gia phản ứngPhương trình sử dụng HBr (Hidro bromua) là chất sản phẩm
(hydrobromic acid)
HBr + C6H11CH3 → H2 + C6H11CH2Br C2H5OH + HBr → H2O + C2H5Br Cl2 + 2HBr → Br2 + 2HCl Tổng hợp tất cả phương trình có HBr tham gia phản ứng















