Chuỗi phản ứng của các chất vô cơ và hữu cơ
Chuỗi các phương trình phản ứng của các chất vô cơ và hữu cơ thường gặp trong sách giáo khóa Hóa học.
Chuỗi phản ứng của các chất vô cơ và hữu cơ
C2HHòa tan kim loại magie trong dung dịch axit HCl thu được khí hidro thoát.
Đốt cháy sắt (II) oxit với khí hidro thu được kim loại sắt.
Hòa tan kim loại sắt trong dung dịch axit sunfuric thu được khí không màu thoát ra và hơi nước.
Điện phân hơi nước thu được 2 khí gồm hidro và oxi.
Đốt khí hidro với khí etilen thu được khí C2H6.
Tóm Tắt Phương Trình Liên Quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Đánh giá
Chi Tiết Phương Trình Liên Quan
Xin lưu ý đây chỉ là phương trình chúng tôi đề nghị, bạn hoàn toàn có thể dùng các phương trình thay thể thỏa điều kiệm của chuỗi
Chi Tiết Phương Trình Số 1
Phương Trình Kết Quả Số #2
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| 2HCl | + | Mg | → | H2 | + | MgCl2 | |
| axit clohidric | magie | hidro | Magie clorua | ||||
| Hydrogen | Magnesium chloride | ||||||
| (dd) | (rắn) | (khí) | (dd) | ||||
| (không màu) | (trắng bạc) | (không màu) | (trắng) | ||||
| Axit | Muối | ||||||
| 2 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2HCl + Mg → H2 + MgCl2
2HCl + Mg → H2 + MgCl2 là Phản ứng oxi-hoá khửPhản ứng thế, HCl (axit clohidric) phản ứng với Mg (magie) để tạo ra H2 (hidro), MgCl2 (Magie clorua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng HCl (axit clohidric) tác dụng Mg (magie) là gì ?
Không có
Làm cách nào để HCl (axit clohidric) tác dụng Mg (magie) xảy ra phản ứng?
Cho một ít kim loại Magie (Mg) vào đáy ống nghiệm, thêm vào 1-2 ml dung dịch axit.
Hiện tượng nhận biết nếu phản ứng xảy ra 2HCl + Mg → H2 + MgCl2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2HCl + Mg → H2 + MgCl2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 2HCl + Mg → H2 + MgCl2
Click để xem tất cả câu hỏi có liên quan tới phương trình 2HCl + Mg → H2 + MgCl2Câu 1. Bài toán khối lượng
Hòa tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 0,6 gam khí H2 bay ra. Khối lượng muối tạo thành trong dung dịch là
A. 35,7 gam
B. 36,7 gam
C. 53,7gam
D. 63,7 gam
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 2
Phương Trình Kết Quả Số #3
Cách viết phương trình đã cân bằng
 |  | _oxide.jpg) |  | ||||
| Fe | + | H2O | → | FeO | + | H2 | |
| sắt | nước | sắt (II) oxit | hidro | ||||
| Iron | Iron (II) oxide | Hydrogen | |||||
| (rắn) | (lỏng) | (rắn) | (khí) | ||||
| (trắng xám) | (không màu) | (đen) | (không màu) | ||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Fe + H2O → FeO + H2
Fe + H2O → FeO + H2 là Phản ứng oxi-hoá khử, Fe (sắt) phản ứng với H2O (nước) để tạo ra FeO (sắt (II) oxit ), H2 (hidro) dười điều kiện phản ứng là Nhiệt độ: > 570
Điều kiện phản ứng Fe (sắt) tác dụng H2O (nước) là gì ?
Nhiệt độ: > 570
Làm cách nào để Fe (sắt) tác dụng H2O (nước) xảy ra phản ứng?
sắt tác dụng với nước
Hiện tượng nhận biết nếu phản ứng xảy ra Fe + H2O → FeO + H2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình Fe + H2O → FeO + H2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình Fe + H2O → FeO + H2
Click để xem tất cả câu hỏi có liên quan tới phương trình Fe + H2O → FeO + H2Câu 1. Phát biểu
Cho các phát biểu sau:
(a). Nung nóng KClO3 (không xúc tác) chỉ thu được KCl và O2.
(b). Lượng lớn thiếc dùng để phủ lên bề mặt của sắt để chống gỉ (sắt tây) dùng
công nghiệp thực phẩm.
(c). Sắt tác dụng với hơi nước ở nhiệt độ cao hơn 570 độ C thu được oxit sắt từ và
khí H2.
(d). Nhôm là nguyên tố đứng hàng thứ hai sau oxi về độ phổ biến trong vỏ Trái Đất
(e). Phản ứng của O2 với N2 xảy ra rất khó khăn là phản ứng không thuận nghịch.
(f). Có thể dùng khí CO2 để dập tắt đám cháy của Mg nhưng không được dùng
H2O
(g). Cho dung dịch AgNO3 vào dung dịch H3PO4 thấy có kết tủa màu vàng.
(h). Nước ta có mỏ quặng apatit (công thức: Ca3(PO4)2) ở Lào Cai.
(i). Trong phòng thí nghiệm CO được điều chế bằng cách đun nóng axit
HCOOH với H2SO4 đặc.
Có tất cả bao nhiêu phát biểu không đúng?
A. 7
B. 4
C. 5
D. 6
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 3
Phương Trình Kết Quả Số #4
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| 2Fe | + | 6H2SO4 | → | Fe2(SO4)3 | + | 6H2O | + | 3SO2 | |
| sắt | axit sulfuric | sắt (III) sulfat | nước | lưu hùynh dioxit | |||||
| Iron | Sulfuric acid; | Iron(III) sulfate | Sulfur đioxit | ||||||
| (rắn) | (dung dịch) | (dd) | (lỏng) | (khí) | |||||
| (trắng xám) | (không màu) | (vàng nâu) | (không màu) | (không màu, mùi hắc) | |||||
| Axit | Muối | ||||||||
| 2 | 6 | 1 | 6 | 3 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2
2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2 là Phản ứng oxi-hoá khử, Fe (sắt) phản ứng với H2SO4 (axit sulfuric) để tạo ra Fe2(SO4)3 (sắt (III) sulfat), H2O (nước), SO2 (lưu hùynh dioxit) dười điều kiện phản ứng là Nhiệt độ: Nhiệt độ.
Điều kiện phản ứng Fe (sắt) tác dụng H2SO4 (axit sulfuric) là gì ?
Nhiệt độ: Nhiệt độ.
Làm cách nào để Fe (sắt) tác dụng H2SO4 (axit sulfuric) xảy ra phản ứng?
cho sắt tác dụng với dung dịch axit sunfuric.
Hiện tượng nhận biết nếu phản ứng xảy ra 2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2
Click để xem tất cả câu hỏi có liên quan tới phương trình 2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2Câu 1. Bài toán khối lượng
Cho m gam hỗn hợp X gồm Cu và Fe vào dung dịch H2SO4 loãng (dư), kết thúc phản ứng thu được 2,24 lít khí H2 (đktc). Khối lượng của Fe trong 2m gam X là
A. 4,48
B. 11,2
C. 16,8
D. 1,12
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 4
Phương Trình Kết Quả Số #5
Cách viết phương trình đã cân bằng
 |  |  | |||
| 2H2O | → | 2H2 | + | O2 | |
| nước | hidro | oxi | |||
| Hydrogen | |||||
| (lỏng) | (khí) | (khí) | |||
| (không màu) | (không màu) | (không màu) | |||
| 2 | 2 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2H2O → 2H2 + O2
2H2O → 2H2 + O2 là Phản ứng oxi-hoá khử, H2O (nước) để tạo ra H2 (hidro), O2 (oxi) dười điều kiện phản ứng là Điều kiện khác: điện phân
Điều kiện phản ứng H2O (nước) là gì ?
Điều kiện khác: điện phân
Làm cách nào để H2O (nước) xảy ra phản ứng?
điện phân nước ở nhiệt độ cao.
Hiện tượng nhận biết nếu phản ứng xảy ra 2H2O → 2H2 + O2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2H2O → 2H2 + O2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 2H2O → 2H2 + O2
Click để xem tất cả câu hỏi có liên quan tới phương trình 2H2O → 2H2 + O2Câu 1. Phản ứng hóa học
Cho các phương trình phản ứng
(1) C4H10 + F2
(2) AgNO3 (t0) →
(3) H2O2 + KNO2
(4) Điện phân dung dịch NaNO3
(5) Mg + FeCl3 dư
(6) H2S + dd Cl2.
Số phản ứng tạo ra đơn chất là:
A. 2
B. 3
C. 4
D. 5
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 5
Phương Trình Kết Quả Số #6
Cách viết phương trình đã cân bằng
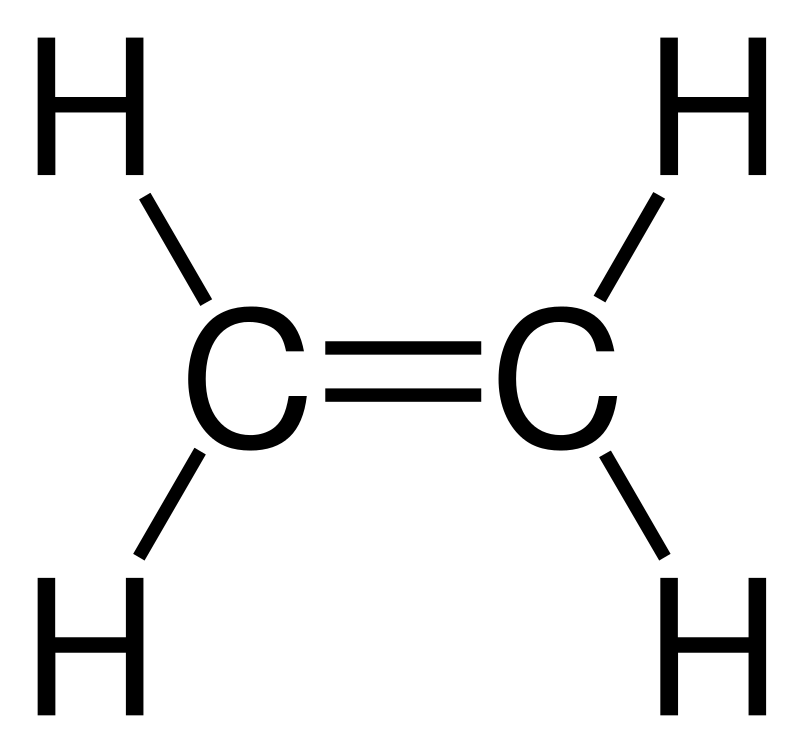 |  | 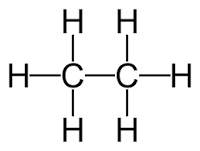 | |||
| C2H4 | + | H2 | → | C2H6 | |
| etilen (eten) | hidro | etan | |||
| Ethene | Hydrogen | ||||
| (khí) | (khí) | (khí) | |||
| (không màu) | |||||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình C2H4 + H2 → C2H6
C2H4 + H2 → C2H6 là Phản ứng oxi-hoá khử, C2H4 (etilen (eten)) phản ứng với H2 (hidro) để tạo ra C2H6 (etan) dười điều kiện phản ứng là Nhiệt độ: Nhiệt độ Xúc tác: Ni
Điều kiện phản ứng C2H4 (etilen (eten)) tác dụng H2 (hidro) là gì ?
Nhiệt độ: Nhiệt độ Xúc tác: Ni
Làm cách nào để C2H4 (etilen (eten)) tác dụng H2 (hidro) xảy ra phản ứng?
cho C2H4 tác dụng với hidro
Hiện tượng nhận biết nếu phản ứng xảy ra C2H4 + H2 → C2H6 là gì ?
Phương trình không có hiện tượng nhận biết đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm C2H6 (etan) (trạng thái: khí), được sinh ra
Hoặc bạn phải quan sát chất tham gia C2H4 (etilen (eten)) (trạng thái: khí), H2 (hidro) (trạng thái: khí) (màu sắc: không màu), biến mất.
Giải thích chi tiết về các phân loại của phương trình C2H4 + H2 → C2H6
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiHãy chia sẽ cho bạn bè nếu nếu tài liệu này là hữu ích nhé
Chia sẻ qua facebook
Hoặc chia sẽ link trực tiếp:
http://v1.phuongtrinhhoahoc.com/chuoi-phuong-trinh-hoa-hoc/chuoi-phan-ung-cua-cac-chat-vo-co-va-huu-co-98Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
















