Chuỗi phản ứng về oxi lưu huỳnh
Chuỗi các phương trình phản ứng của lưu huỳnh và hợp chất của lưu huỳnh, các phương trình thường gặp trong chương trình Hóa học lớp 10.
Chuỗi phản ứng về oxi lưu huỳnh
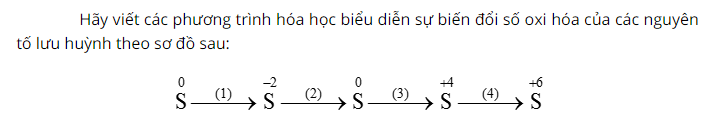
Cho lưu huỳnh phản ứng với khí hidro sản phẩm tạo thành là khí hidro sunfua (H2S) có mùi trứng thối, mùi sốc.
Tiếp tục cho khí H2S phản ứng với oxi sau phản ứng thu được lưu huỳnh và nước.
Sau đó, đốt cháy lưu huỳnh trong không khí, sau phản ứng có khí không màu, mùi hắc thoát ra là khí SO2.
Cuối cùng, sục khí SO2 trong dung dịch nước Br2 sản phẩm thu được có axit sunfuric.
Tóm Tắt Phương Trình Liên Quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Đánh giá
Chi Tiết Phương Trình Liên Quan
Xin lưu ý đây chỉ là phương trình chúng tôi đề nghị, bạn hoàn toàn có thể dùng các phương trình thay thể thỏa điều kiệm của chuỗi
Chi Tiết Phương Trình Số 1
Phương Trình Kết Quả Số #2
Cách viết phương trình đã cân bằng
 |  |  | |||
| H2 | + | S | → | H2S | |
| hidro | sulfua | hidro sulfua | |||
| Hydrogen | Hydro sulfid, hydro sulfua, sunfan | ||||
| (khí) | (rắn) | (khí) | |||
| (không màu) | (vàng chanh) | (không màu) | |||
| Axit | |||||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình H2 + S → H2S
H2 + S → H2S là Phản ứng hoá hợpPhản ứng oxi-hoá khử, H2 (hidro) phản ứng với S (sulfua) để tạo ra H2S (hidro sulfua) dười điều kiện phản ứng là Nhiệt độ: < 350
Điều kiện phản ứng H2 (hidro) tác dụng S (sulfua) là gì ?
Nhiệt độ: < 350
Làm cách nào để H2 (hidro) tác dụng S (sulfua) xảy ra phản ứng?
cho hidro tác dụng với lưu huỳnh
Hiện tượng nhận biết nếu phản ứng xảy ra H2 + S → H2S là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình H2 + S → H2S
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình H2 + S → H2S
Click để xem tất cả câu hỏi có liên quan tới phương trình H2 + S → H2SCâu 1. Ozon
Cho các nhận định sau:
(1). O3 có tính oxi hóa mạnh hơn O2.
(2). Ozon được ứng dụng vào tẩy trắng tinh bột, dầu ăn.
(3). Ozon được ứng dụng vào sát trùng nước sinh hoạt.
(4). Ozon được ứng dụng vào chữa sâu răng.
(5). Ozon được ứng dụng vào điều chế oxi trong PTN.
(6). Hiđro peoxit vừa có tính oxi hóa, vừa có tính khử.
(7). Tổng hệ số các chất trong phương trình
2KMnO4 +5H2O2 +3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O.
khi cân bằng với hệ số nguyên nhỏ nhất là 26.
(8). S vừa có tính oxi hóa vừa có tính khử.
Số nhận định đúng là:
A. 6
B. 7
C. 8
D. 9
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 2
Phương Trình Kết Quả Số #3
Cách viết phương trình đã cân bằng
 |  |  |  | ||||
| 2H2S | + | O2 | → | 2H2O | + | 2S | |
| hidro sulfua | oxi | nước | sulfua | ||||
| Hydro sulfid, hydro sulfua, sunfan | |||||||
| (khí) | (khí) | (lỏng) | (rắn) | ||||
| (không màu) | (không màu) | (không màu) | (vàng) | ||||
| Axit | |||||||
| 2 | 1 | 2 | 2 | Hệ số | |||
| Nguyên - Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình 2H2S + O2 → 2H2O + 2S
2H2S + O2 → 2H2O + 2S là Phương Trình Phản Ứng Hóa Học, H2S (hidro sulfua) phản ứng với O2 (oxi) để tạo ra H2O (nước), S (sulfua) dười điều kiện phản ứng là Điều kiện khác: nhiệt độ cao; O2 thiếu; hidro sunfua bão hòa
Điều kiện phản ứng H2S (hidro sulfua) tác dụng O2 (oxi) là gì ?
Điều kiện khác: nhiệt độ cao; O2 thiếu; hidro sunfua bão hòa
Làm cách nào để H2S (hidro sulfua) tác dụng O2 (oxi) xảy ra phản ứng?
Cho hidro sunfua bão hòa tác dụng với oxi thiếu
Hiện tượng nhận biết nếu phản ứng xảy ra 2H2S + O2 → 2H2O + 2S là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình 2H2S + O2 → 2H2O + 2S
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 3
Phương Trình Kết Quả Số #4
Cách viết phương trình đã cân bằng
 |  |  | |||
| O2 | + | S | → | SO2 | |
| oxi | sulfua | lưu hùynh dioxit | |||
| Sulfur đioxit | |||||
| (khí) | (rắn) | (khí) | |||
| (không màu) | (vàng) | (không màu) | |||
| 1 | 1 | 1 | Hệ số | ||
| Nguyên - Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình O2 + S → SO2
O2 + S → SO2 là Phản ứng hoá hợpPhản ứng oxi-hoá khử, O2 (oxi) phản ứng với S (sulfua) để tạo ra SO2 (lưu hùynh dioxit) dười điều kiện phản ứng là Nhiệt độ: 280 - 360°C Điều kiện khác: cháy trong không khí , hỗn hợp của SO3
Điều kiện phản ứng O2 (oxi) tác dụng S (sulfua) là gì ?
Nhiệt độ: 280 - 360°C Điều kiện khác: cháy trong không khí , hỗn hợp của SO3
Làm cách nào để O2 (oxi) tác dụng S (sulfua) xảy ra phản ứng?
Chúng mình không thông tin về làm thế nào để O2 (oxi) phản ứng với S (sulfua) và tạo ra chất SO2 (lưu hùynh dioxit).
Bạn có thể kéo xuống dưới và click vào nút báo lỗi để đóng góp thông tin cho chúng mình nhé.Hiện tượng nhận biết nếu phản ứng xảy ra O2 + S → SO2 là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình O2 + S → SO2
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình O2 + S → SO2
Click để xem tất cả câu hỏi có liên quan tới phương trình O2 + S → SO2Câu 1. Chọn nhận định đúng
Cho các phát biểu và nhận định sau:
(1). Tác nhân chủ yếu gây mưa axit là H2S và NO.
(2). Khí CH4; CO2 gây ra hiện tượng hiệu ứng nhà kính
(3). Chất gây nghiện chủ yếu trong thuốc lá là nicotin.
(4). Ozon trong khí quyển là nguyên nhân gây ô nhiễm không khí
Số phát biểu đúng là:
A. 2
B. 4
C. 3
D. 1
Xem đáp án câu 1
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiChi Tiết Phương Trình Số 4
Phương Trình Kết Quả Số #5
Cách viết phương trình đã cân bằng
 |  |  |  |  | |||||
| Br2 | + | H2O | + | SO2 | → | H2SO4 | + | 2HBr | |
| brom | nước | lưu hùynh dioxit | axit sulfuric | Hidro bromua | |||||
| Bromine | Sulfur đioxit | Sulfuric acid; | Axit bromhydric | ||||||
| (lỏng) | (lỏng) | (khí) | (lỏng) | (lỏng) | |||||
| (nâu đỏ) | (không màu) | (không màu) | (không màu) | (không màu) | |||||
| Axit | Axit | ||||||||
| 1 | 1 | 1 | 1 | 2 | Hệ số | ||||
| Nguyên - Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Thông tin chi tiết về phương trình Br2 + H2O + SO2 → H2SO4 + 2HBr
Br2 + H2O + SO2 → H2SO4 + 2HBr là Phản ứng oxi-hoá khử, Br2 (brom) phản ứng với H2O (nước) phản ứng với SO2 (lưu hùynh dioxit) để tạo ra H2SO4 (axit sulfuric), HBr (Hidro bromua) dười điều kiện phản ứng là Không có
Điều kiện phản ứng Br2 (brom) tác dụng H2O (nước) tác dụng SO2 (lưu hùynh dioxit) là gì ?
Không có
Làm cách nào để Br2 (brom) tác dụng H2O (nước) tác dụng SO2 (lưu hùynh dioxit) xảy ra phản ứng?
Sục khí SO2 vào dung dịch Brom
Hiện tượng nhận biết nếu phản ứng xảy ra Br2 + H2O + SO2 → H2SO4 + 2HBr là gì ?
Click để xem thông tin thêmGiải thích chi tiết về các phân loại của phương trình Br2 + H2O + SO2 → H2SO4 + 2HBr
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báo cho chúng mình biết nhé
Click vào đây để báo lỗiHãy chia sẽ cho bạn bè nếu nếu tài liệu này là hữu ích nhé
Chia sẻ qua facebook
Hoặc chia sẽ link trực tiếp:
http://v1.phuongtrinhhoahoc.com/chuoi-phuong-trinh-hoa-hoc/chuoi-phan-ung-ve-oxi-luu-huynh-12Xác nhận nội dung
Hãy giúp Phương Trình Hóa Học chọn lọc những nội dung tốt bạn nhé!
















