Phân lớp electron
Những electron trong mỗi lớp lượng tử có cùng phân mức năng lượng họp thành ...
Giới thiệu khái niệm
Những electron trong mỗi lớp lượng tử có cùng phân mức năng lượng họp thành phân lớp lượng tử hay phân lớp electron. Từ đây trong mỗi lớp electron có n phân lớp electron. Trạng thái của electron trong nguyên tử tương ứng với những giá trị nhất định của các số lượng tử n và l được biểu diễn bằng tổ hợp của giá trị số lượng tử n và ký hiệu số lượng tử l như sau: 1s, 2s, 2p, 3s, 3d, 4f....
Chi tiết khái niệm
Theo điều kiện lượng tử hóa không những năng lượng electron trong nguyên tử chỉ có thể có những giá trị nhất định mà cả đám mây electron cũng không thể có hình dạng bất kỳ
Trái lại, hình dạng của đám mây electron được xác định hoàn toàn bằng số lượng tử orbital l.
Số lượng tử orbital (hay còn gọi là số lượng tử phụ hoặc phương vị) cũng có những giá trị nguyên, dương, tuy nhiên số giá trị của nó bị ràng buộc bởi số lượng tử chính n. Thực vậy, đối với mỗi giá trị của n, số lượng tử orbital có những giá trị từ 0 đến (n-1):
l = 0,1,2,3..., (n-1)
Ví dụ: với n = 1 có 1 giá trị là l = 0
n = 2 có 2 giá trị là l = 0 và 1
n = 3 có 3 giá trị là l = 0, 1 và 2
Như vậy, ứng với mỗi giá trị của n có n giá trị khác nhau của l.
Đối với nguyên tử nhiều electron thì các trạng thái năng lượng của những electron ở cùng mức năng lượng không phải hoàn toàn giống nhau mà có khác nhau chút ít do chịu ảnh hưởng của nhiều yếu tố mới xuất hiện và được đặc trưng bằng số lượng tử orbital l. Người ta gọi trạng thái năng lượng của electron được đặc trưng bằng giá trị nhất định của l là phân mức năng lượng. Trị số của l càng lớn thì phân mức năng lượng có giá trị càng cao. Những electron trong mỗi lớp lượng tử có cùng phân mức năng lượng họp thành phân lớp lượng tử hay phân lớp electron. Các phân lớp lượng tử (hoặc các phân mức năng lượng) được ký hiệu bằng chữ cái thường như sau
Từ đây trong mỗi lớp electron có n phân lớp electron.
Trạng thái của electron trong nguyên tử tương ứng với những giá trị nhất định của các số lượng tử n và l được biểu diễn bằng tổ hợp của giá trị số lượng tử n và của ký hiệu số lượng tử l như sau: 1s, 2s, 2p, 3s 3d, 4f....
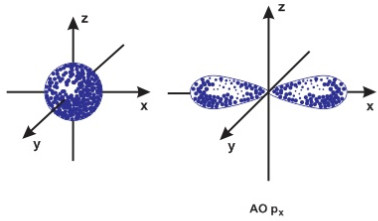
Số lượng tử orbital l xác định hình dạng đám mây electron, nghĩa là ứng với mỗi giá trị của l đám mây electron có hình dạng nhất định. Theo kết quả tính toán của cơ học lượng tử thì các đám mây electron tương ứng trạng thái s (l=0) có dạng khối cầu, tương ứng trạng thái p (l=1) có dạng 2 khối cầu biến dạng tiếp xúc nhau, tương ứng với trạng thái l =2 có dạng bốn khối cầu biến dạng tiếp xúc nhau....Các đám mây ứng với các trạng thái f, g.. có hình dạng phức tạp hơn nhiều.
Tìm hiểu thêm Phân lớp electron
Đánh giá
Xem thêm các khái niệm liên quan
Cấu tạo bảng tuần hoàn
Hệ thống tuần hoàn các nguyên tố hóa học được Mendeleev chính thức công bố năm 1871 có dạng của một bảng gồm 66 nguyên tố, chia thành 8 nhóm đứng và 12 dãy ngang. Cho đến nay đã có hơn 400 kiểu biểu diễn được công bố, nhưng thực tế chỉ có hai kiểu trong số đó được phổ biến và ứng dụng rộng rãi. Đó là bảng hệ thống tuần hoàn dạng ngắn và dạng dài mà hiện nay chúng ta đang sử dụng và cơ sở của chúng vẫn là cách biểu điễn của Mendeleev.
Xem chi tiếtĐiện hóa trị
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích của ion đó
Xem chi tiếtCộng hóa trị
Hóa trị của một nguyên tố trong hợp chất cộng hóa trị gọi là cộng hóa trị và bằng số liên kết cộng hóa trị mà nguyên tử của nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử.
Xem chi tiết













